题目内容
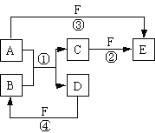
【题目】在如图串联装置中,通电片刻即发现乙装置左侧电极表面出现红色固体,则下列说法不正确的是( )
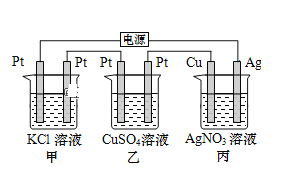
A.标准状况下当甲中产生4.48L气体时,丙中Cu电极质量增加21.6g
B.电解过程中丙中溶液pH无变化
C.向甲中加入适量的盐酸,可使溶液恢复到电解前的状态
D.乙中左侧电极反应式:Cu2++2e-=Cu
【答案】C
【解析】
通电片刻即发现乙装置左侧电极表面出现红色固体,则表明此电极中Cu2+获得电子生成铜,附着在电极表面,所以此电极为阴极。因为三个电池串联,所以各电池中左边电极都为阴极,右边电极都为阳极。
A. 甲装置为电解KCl的装置,阳极生成氯气,阴极生成氢气,标准状况下当甲中产生4.48L气体时,线路中转移电子0.2mol。丙中线路上转移电子也为0.2mol,Cu电极上析出0.2molAg,质量增加21.6g,正确 ;
B. 丙装置为电镀装置,电解后,AgNO3溶液的组成和浓度不变,电解过程中丙中溶液pH无变化,正确;
C. 甲中电解后,有一部分KCl转化为KOH,向甲中加入适量的盐酸,可使KOH转化为KCl,但溶液中的溶剂量增加,溶液浓度减小,不可能恢复到电解前的状态,错误;
D. 乙中左侧电极为阴极,电极反应式:Cu2++2e-=Cu,正确。
故答案为C。

【题目】硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol1)可用作定影剂、还原剂。回答下列问题:
(1)已知:Ksp(BaSO4)=1.1×1010,Ksp(BaS2O3)=4.1×105。市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验:
试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液
完成下列表格
实验步骤 | 现象 |
①取少量样品,加入除氧蒸馏水 | ②固体完全溶解得无色澄清溶液 |
③加入过量稀盐酸 | ④___________,有刺激性气体产生 |
⑤静置,(吸)取上层清液,滴入BaCl2溶液 | ⑥_______________________________ |
(2)利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在烧杯中溶解,完全溶解后,全部转移至100 mL的_________中,加蒸馏水至刻线。
②滴定:用___________________取0.00950 mol·L1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应: Cr2O72—+6I+14H+=3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32—=S4O62—+2I。加入淀粉溶液作为指示剂,继续滴定,当溶液_____________________,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。
【题目】下述实验方案能达到实验目的的是( )
编号 | A | B | C | D |
实验方案 |
|
|
|
|
实验目的 | 实验室制备乙酸乙酯 | 分离乙酸和水 | 验证溴乙烷在氢氧化钠乙醇溶液中发生消去反应产生的乙烯 | 收集乙烯并验证它与溴水发生加成反应 |
A. A B. B C. C D. D