题目内容
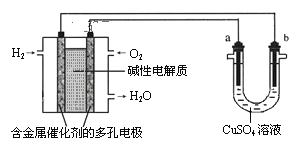
【题目】用碱性氢氧燃料电池为电源进行电解的实验装置示意图如图所示。下列说法中正确的是( )
A.燃料电池工作时负极反应为:H2=2H++2e-
B.若要实现铁上镀铜,则a极是铁,b极是铜
C.若要实现电解精炼粗铜,则a极发生氧化反应,b极上有铜析出
D.a、b两极均是石墨时,在相同条件下,当电池中消耗H222.4L(标准状况)时,a极析出铜64g
【答案】C
【解析】
分析原电池或电解池类试题的实验装置时,解题的切入点是正负极的判断。从图中可以看出,左边电池为燃料电池,右边电池为电解池。通H2的电极为负极,通O2的电极为正极;右边装置中,a电极为阳极,b电极为阴极。
A. 燃料电池工作时负极反应式为:H2-2e-+2OH-=2H2O,错误;
B. 若要实现铁上镀铜,则a极是铜,b极是铁,错误;
C. 若要实现电解精炼粗铜,则a极为阳极,失电子,发生氧化反应,b极为阴极,Cu2+得电子,有铜析出,正确;
D. a、b两极均是石墨时,在相同条件下当电池中消耗H222.4L(标准状况)时,线路中转移电子为2mol,b极为阴极,析出铜64g,a极为阳极,不能析出铜,错误。
故答案为C。

【题目】下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)在这些元素中,金属性最强的元素是_____,最活泼的非金属元素是_______________
(2)化学性质最不活泼的元素是______________,其原子的原子结构示意图为___________;
(3)元素的最高价氧化物对应的水化物中酸性最强的是______________,碱性最强的是____________,
(4)在③~⑦元素中,原子半径最大的是________,原子半径最小的是_______;
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的处理工艺流程如下。

其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)酸浸时,为了提高浸取率可采取的措施有______________![]() 答出两点
答出两点![]() 。
。
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:_____________。
(3)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 |
|
|
|
沉淀完全时的pH | 3.7 | 11.1 | 8 | 9(>9溶解) |
加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-。滤液Ⅱ中阳离子主要有________;但溶液的pH不能超过8,其理由是_______________。
(4)写出上述流程中用SO2进行还原时发生反应的化学方程式: ____________。
(5)滴定法测定纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品Wg,放入锥形瓶中加蒸馏水溶解,加1~2滴酚酞指示剂,用cmol/L的HCl溶液滴定至溶液由红色变为无色![]() 指示
指示![]() 反应的终点
反应的终点![]() ,所用HCl溶液体积为V1mL,再加1~2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄色变为橙色,所用HCI溶液总体积为V2mL,则纯碱样品中NaHCO3质量分数为____________。
,所用HCl溶液体积为V1mL,再加1~2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄色变为橙色,所用HCI溶液总体积为V2mL,则纯碱样品中NaHCO3质量分数为____________。





