题目内容
(15分)
亚硝酸钠(NaNO2)易溶于水,微溶于乙醚,是常用的食品发色剂
(1)第一电离能:N ___O(填“<”、“>”或“=”);NO2-的空间构型为____
(2)亚硝酸钠在3200C会分解生成氧化钠、一氧化二氮等物质,该反应的化学方程式为____
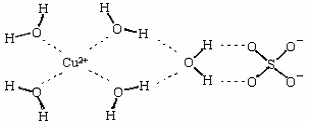
(3)亚硝酸钠是亚硝酸的钠盐。HNO2的结构如图所示,则HNO2分子中有___个 键:
键:
HNO2的酸性比HN03弱是因为_____

(4)亚硝基钻钠 是钴的一种配合物,易溶于水,与钾离子反应生成淡黄色的
是钴的一种配合物,易溶于水,与钾离子反应生成淡黄色的
 沉淀,可用于检验K+的存在。
沉淀,可用于检验K+的存在。
①基态 的价层电子排布图为_____
的价层电子排布图为_____
②用亚硝酸钻钠检验K+的离子方程式是
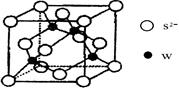
③金属钴的堆积方式如图所示,若一个钴原子的半径为r,,则晶胞的体积V(晶胞)=__
亚硝酸钠(NaNO2)易溶于水,微溶于乙醚,是常用的食品发色剂
(1)第一电离能:N ___O(填“<”、“>”或“=”);NO2-的空间构型为____
(2)亚硝酸钠在3200C会分解生成氧化钠、一氧化二氮等物质,该反应的化学方程式为____
(3)亚硝酸钠是亚硝酸的钠盐。HNO2的结构如图所示,则HNO2分子中有___个
 键:
键:HNO2的酸性比HN03弱是因为_____

(4)亚硝基钻钠
 是钴的一种配合物,易溶于水,与钾离子反应生成淡黄色的
是钴的一种配合物,易溶于水,与钾离子反应生成淡黄色的 沉淀,可用于检验K+的存在。
沉淀,可用于检验K+的存在。①基态
 的价层电子排布图为_____
的价层电子排布图为_____②用亚硝酸钻钠检验K+的离子方程式是
③金属钴的堆积方式如图所示,若一个钴原子的半径为r,,则晶胞的体积V(晶胞)=__
(15分)
(1) > (1分) V型或角型(1分)
(2)2NaNO2 Na2O+N2O↑+O2↑(2分)
Na2O+N2O↑+O2↑(2分)
(3)3(2分)
HNO3中的N的正电性高,导致N—O—H中O的电子向N偏移程度大于HNO3,更容易电离出H+,酸性更强(3分)

(1) > (1分) V型或角型(1分)
(2)2NaNO2
 Na2O+N2O↑+O2↑(2分)
Na2O+N2O↑+O2↑(2分)(3)3(2分)
HNO3中的N的正电性高,导致N—O—H中O的电子向N偏移程度大于HNO3,更容易电离出H+,酸性更强(3分)

试题分析:(1)因为N元素为VA族元素,N原子2p轨道排布3个电子,为半充满状态,为较稳定状态,失去电子较难,所以第一电离能:N > O;NO2-中N价电子为5,所以杂化轨道数=(5+1)÷2=3,所以N原子杂化方式为sp2,所以NO2-的空间构型为V型或角型。
(2)亚硝酸钠在3200C会分解生成氧化钠、一氧化二氮等物质,配平可得化学方程式:2NaNO2
 Na2O +N2O↑+O2↑
Na2O +N2O↑+O2↑(3)单键为
 键,双键中的一个键为
键,双键中的一个键为 键,根据HNO2的结构简式可知HNO2分子中有3个
键,根据HNO2的结构简式可知HNO2分子中有3个 键;HNO3中的N的正电性高,导致N—O—H中O的电子向N偏移程度大于HNO3,更容易电离出H+,酸性更强。
键;HNO3中的N的正电性高,导致N—O—H中O的电子向N偏移程度大于HNO3,更容易电离出H+,酸性更强。(4)①Co为27号元素,Co3+的价层电子为3d6,所以基态Co3+的3d轨道有1个排布2个电子,其它4个轨道排布1个电子。
②根据亚硝基钻钠{Na3[Co(NO2)6]}与钾离子反应生成淡黄色的K2Na[Co(NO2)6]沉淀,可得离子方程式为:2K++Na++[Co(NO2)6]3- = K2Na[Co(NO2)6]↓
③根据钴晶体堆积方式可知,其晶胞为面向立方,面对角线等于4r,设晶胞的边长为a,则4r=
 a,可得a=2
a,可得a=2 r,则晶胞的体积V(晶胞)=a3=(2
r,则晶胞的体积V(晶胞)=a3=(2 r)3=16
r)3=16 r3。
r3。
练习册系列答案
相关题目
 族
族