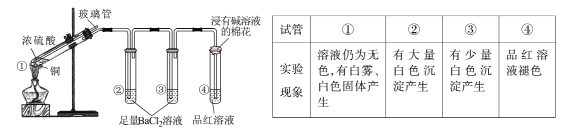
题目内容
【题目】氧元素为地壳中含量最高的元素,可形成多种重要的单质和化合物。
(1)氧元素位于元素周期表中_____区;第二周期元素中,第一电离能比氧大的有_____种。
(2)O3可用于消毒。O3的中心原子的杂化形式为_____;其分子的VSEPR模型为_____,与其互为等电子体的离子为_____(写出一种即可)。
(3)含氧有机物中,氧原子的成键方式不同会导致有机物性质不同。解释C2H5OH的沸点高于CH3OCH3的原因为_____。
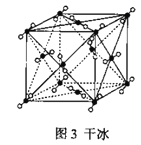
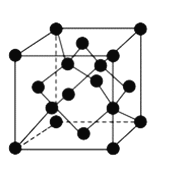
(4)氧元素可与Fe形成低价态氧化物FeO。FeO立方晶胞结构如图所示,则Fe2+的配位数为_____;与O2-紧邻的所有Fe2+构成的几何构型为_____。
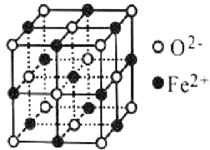
【答案】p 3 sp2杂化 平面三角形 NO2- 乙醇分子间可形成氢键,沸点高 6 正八面体
【解析】
(1)除了ds区外,区的名称来自按构造原理最后填入电子的能级的符号;第二周期元素中,第一电离能比O元素大的有N、F、Ne元素;
(2)O3的中心原子的价层电子对个数=2+![]() =3且含有1个孤电子对,根据价层电子对互斥理论判断中心原子的杂化形式及其分子的VSEPR模型,与其互为等电子体的离子中含有3个原子、价电子数是18;
=3且含有1个孤电子对,根据价层电子对互斥理论判断中心原子的杂化形式及其分子的VSEPR模型,与其互为等电子体的离子中含有3个原子、价电子数是18;
(3)形成分子间氢键的物质熔沸点较高;
(4)Fe2+的配位数为6;与O2-紧邻的所有Fe2+构成的几何构型为正八面体。
(1)除了ds区外,区的名称来自按构造原理最后填入电子的能级的符号,O原子最后通入的电子是p电子,所以O元素位于p区;第二周期元素中,第一电离能比O元素大的有N、F、Ne元素,所以有3种元素;
(2)O3的中心原子的价层电子对个数=2+![]() =3且含有1个孤电子对,根据价层电子对互斥理论判断中心原子的杂化形式为sp2杂化、其分子的VSEPR模型为平面三角形,与其互为等电子体的离子中含有3个原子、价电子数是18,与其互为等电子体的阴离子有NO2-(合理即可);
=3且含有1个孤电子对,根据价层电子对互斥理论判断中心原子的杂化形式为sp2杂化、其分子的VSEPR模型为平面三角形,与其互为等电子体的离子中含有3个原子、价电子数是18,与其互为等电子体的阴离子有NO2-(合理即可);
(3)形成分子间氢键的物质熔沸点较高,乙醇能形成分子间氢键、甲醚不能形成分子间氢键,所以乙醇的熔沸点比甲醚高;
(4)Fe2+的配位数为6;与O2-紧邻的所有Fe2+构成的几何构型、与Fe2+紧邻的所有O2-构成的几何构型相同,根据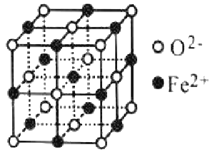 知,表中有标记的这几个离子形成正八面体,则与O2-紧邻的所有Fe2+构成的几何构型为正八面体。
知,表中有标记的这几个离子形成正八面体,则与O2-紧邻的所有Fe2+构成的几何构型为正八面体。

 名校课堂系列答案
名校课堂系列答案【题目】[实验化学]
3,5-二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5-二甲氧基苯酚的部分物理性质见下表:
物质 | 沸点/℃ | 熔点/℃ | 密度(20℃) / g·cm-3 | 溶解性 |
甲醇 | 64. 7 |
| 0. 7915 | 易溶于水 |
乙醚 | 34. 5 |
| 0. 7138 | 微溶于水 |
3,5-二甲氧基苯酚 |
| 33 ~36 |
| 易溶于甲醇、乙醚,微溶于水 |
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取。①分离出甲醇的操作是的_________。
②萃取用到的分液漏斗使用前需_______并洗净,分液时有机层在分液漏斗的_____填(“上”或“下”)层。
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3溶液洗涤的目的是______________;用饱和食盐水洗涤的目的是______________。
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是_____(填字母)。
a.蒸馏除去乙醚 b..重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤。为了防止倒吸,减压过滤完成后应先_______,再______。