题目内容
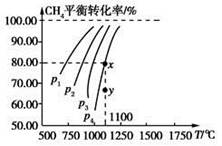
在一恒容的密闭容器中充入0.1 mol/L CO2、0.1 mol/L CH4,在一定条件下发生反应:CH4(g)+CO2(g)  2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是
2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是
 2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是
2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是
| A.上述反应的ΔH<0 |
| B.压强:p4>p3>p2>p1 |
| C.1100 ℃时该反应平衡常数为1.64 |
| D.压强为p4时,在y点:v正>v逆 |
A
本题考查了化学平衡,意在考查考生对化学平衡移动原理的理解及计算能力。由图像可知,压强一定时,温度越高,甲烷的平衡转化率越高,故正反应为吸热反应,ΔH>0,A项错误;该反应为气体分子数增加的反应,压强越高,甲烷的平衡转化率越小,故压强p4>p3>p2>p1,B项正确;1100 ℃时,甲烷的平衡转化率为80.00%,故平衡时各物质的浓度分别为c(CH4)=0.02 mol/L,c(CO2)=0.02 mol,c(CO)=0.16 mol/L,c(H2)=0.16 mol/L,即平衡常数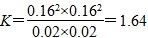 ,C项正确;压强为p4时,y点未达到平衡,此时v正>v逆,D项正确。
,C项正确;压强为p4时,y点未达到平衡,此时v正>v逆,D项正确。
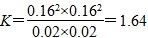 ,C项正确;压强为p4时,y点未达到平衡,此时v正>v逆,D项正确。
,C项正确;压强为p4时,y点未达到平衡,此时v正>v逆,D项正确。
练习册系列答案
相关题目
 Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。下列判断正确的是
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。下列判断正确的是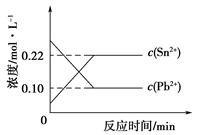
 CH3OCH3(g)+3H2O(g) △H=-122.4kJ·mol-1
CH3OCH3(g)+3H2O(g) △H=-122.4kJ·mol-1
 (填“增大”“不变”或“减小”)。用碳酸钾溶液吸收空气中CO2,当溶渡呈中性时,下列关系或说法正确的是 。
(填“增大”“不变”或“减小”)。用碳酸钾溶液吸收空气中CO2,当溶渡呈中性时,下列关系或说法正确的是 。 )+c(HCO
)+c(HCO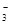 )+c(H2CO3)
)+c(H2CO3) c(CO
c(CO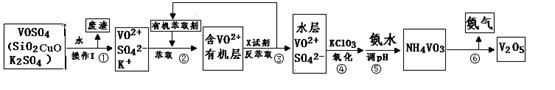
 VOM2(有机层) + H2SO4 (水层)
VOM2(有机层) + H2SO4 (水层) 
 2Z(气),压强一定时,测得在平衡时Z的体积分数为0.4。
2Z(气),压强一定时,测得在平衡时Z的体积分数为0.4。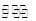 C(g)+D(g),当混合气体的密度不再改变时,说明已达到化学平衡状态
C(g)+D(g),当混合气体的密度不再改变时,说明已达到化学平衡状态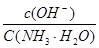 增大
增大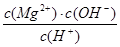 不变
不变 2NH3一定处于平衡状态的是……… ( )
2NH3一定处于平衡状态的是……… ( )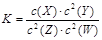 ,有关该平衡体系的说法正确的是
,有关该平衡体系的说法正确的是 2Z(g) + 2W(g)
2Z(g) + 2W(g)