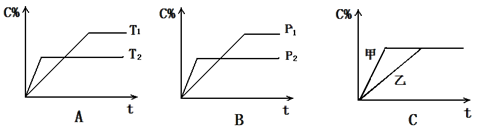题目内容
(19分)钒有金属“维生素”之称,研究发现钒的某些化合物对治疗糖尿病有很好的疗效。
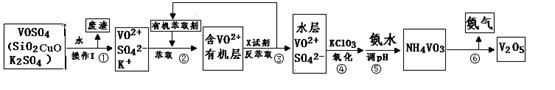
工业上设计将VOSO4中的K2SO4、SiO2、CuO杂质除去并回收得到V2O5的流程如下:
请回答下列问题:
(1)步骤②、③的变化过程可表示为(HM为有机萃取剂):
VOSO4 (水层)+ 2HM(有机层)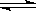 VOM2(有机层) + H2SO4 (水层)
VOM2(有机层) + H2SO4 (水层)
步骤②中萃取时必须加入适量碱,其原因是 。
步骤③中X试剂为 。
(2)步骤④的离子方程式为
(3)该工艺流程中,可以循环利用的物质有 和 。
(4)操作Ⅰ得到的废渣,用 溶解,充分反应后, ,(填写系列操作名称)称量得到mg氧化铜。
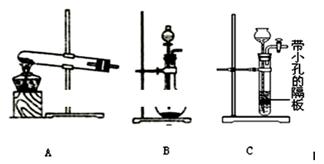
(5)为了制得氨水,甲、乙两小组选择了不同方法制取氨气,请将实验装置的字母编号和制备原理填写在下表空格中。
工业上设计将VOSO4中的K2SO4、SiO2、CuO杂质除去并回收得到V2O5的流程如下:

请回答下列问题:
(1)步骤②、③的变化过程可表示为(HM为有机萃取剂):
VOSO4 (水层)+ 2HM(有机层)
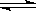 VOM2(有机层) + H2SO4 (水层)
VOM2(有机层) + H2SO4 (水层) 步骤②中萃取时必须加入适量碱,其原因是 。
步骤③中X试剂为 。
(2)步骤④的离子方程式为
(3)该工艺流程中,可以循环利用的物质有 和 。
(4)操作Ⅰ得到的废渣,用 溶解,充分反应后, ,(填写系列操作名称)称量得到mg氧化铜。
(5)为了制得氨水,甲、乙两小组选择了不同方法制取氨气,请将实验装置的字母编号和制备原理填写在下表空格中。

| | 实验装置 | 实验药品 | 制备原理 |
| 甲小组 | A | 氢氧化钙、氯化铵 | 反应的化学方程式为① |
| 乙小组 | ② | 浓氨水、氢氧化钠固体 | 分析产生氨气的原因③ |
(1)加入碱中和硫酸,促使平衡正向移动,提高钒的萃取率(2分);H2SO4(2分)
(2)ClO3-+6VO2++9H2O= Cl-+6VO3-+18H+(3分)
(3)氨气(或氨水)(1分);有机萃取剂(1分)
(4) 氢氧化钠溶液(1分) 过滤、洗涤、干燥(2分)
(5)① 2NH4Cl+Ca(OH)2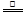 CaCl2+2H2O+2NH3↑。(2分)② B (2分)
CaCl2+2H2O+2NH3↑。(2分)② B (2分)
③氢氧化钠溶于水放出大量热,温度升高,使氨的溶解度减小而放出;氧氧化钠吸水,促使氨放出;氢氧化钠电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡左移,导致氨气放出。 (3分)
(2)ClO3-+6VO2++9H2O= Cl-+6VO3-+18H+(3分)
(3)氨气(或氨水)(1分);有机萃取剂(1分)
(4) 氢氧化钠溶液(1分) 过滤、洗涤、干燥(2分)
(5)① 2NH4Cl+Ca(OH)2
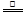 CaCl2+2H2O+2NH3↑。(2分)② B (2分)
CaCl2+2H2O+2NH3↑。(2分)② B (2分)③氢氧化钠溶于水放出大量热,温度升高,使氨的溶解度减小而放出;氧氧化钠吸水,促使氨放出;氢氧化钠电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡左移,导致氨气放出。 (3分)
试题分析:(1)根据题意知,步骤②、③的变化过程可表示为(HM为有机萃取剂):
VOSO4 (水层)+ 2HM(有机层)
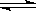 VOM2(有机层) + H2SO4 (水层) ,萃取过程该平衡正向移动,反萃取过程该平衡逆向移动;步骤②中萃取时必须加入适量碱,其原因是加入碱中和硫酸,促使平衡正向移动,提高钒的萃取率。步骤③中X试剂为H2SO4。(2)根据题给流程图知,步骤④为ClO3-将6VO2+氧化为VO3-,根据氧化还原方程式及离子方程式的书写原则写出该反应的离子方程式为ClO3-+6VO2++9H2O= Cl-+6VO3-+18H+。(3)由题给工艺流程知,可以循环利用的物质有氨气(或氨水)和有机萃取剂。(4)操作Ⅰ为溶解操作,二氧化硅和氧化铜不溶于水,得到的废渣为二氧化硅和氧化铜的混合物,二氧化硅为酸性氧化物,氧化铜为碱性氧化物,故用氢氧化钠溶液溶解,充分反应后,过滤、洗涤、干燥,称量得到mg氧化铜。(5)甲小组为氢氧化钙和氯化铵固体共热生成氯化钙、氨气和水,化学方程式为2NH4Cl+Ca(OH)2
VOM2(有机层) + H2SO4 (水层) ,萃取过程该平衡正向移动,反萃取过程该平衡逆向移动;步骤②中萃取时必须加入适量碱,其原因是加入碱中和硫酸,促使平衡正向移动,提高钒的萃取率。步骤③中X试剂为H2SO4。(2)根据题给流程图知,步骤④为ClO3-将6VO2+氧化为VO3-,根据氧化还原方程式及离子方程式的书写原则写出该反应的离子方程式为ClO3-+6VO2++9H2O= Cl-+6VO3-+18H+。(3)由题给工艺流程知,可以循环利用的物质有氨气(或氨水)和有机萃取剂。(4)操作Ⅰ为溶解操作,二氧化硅和氧化铜不溶于水,得到的废渣为二氧化硅和氧化铜的混合物,二氧化硅为酸性氧化物,氧化铜为碱性氧化物,故用氢氧化钠溶液溶解,充分反应后,过滤、洗涤、干燥,称量得到mg氧化铜。(5)甲小组为氢氧化钙和氯化铵固体共热生成氯化钙、氨气和水,化学方程式为2NH4Cl+Ca(OH)2 CaCl2+2H2O+2NH3↑;乙小组用浓氨水和氢氧化钠固体不加热制氨气,应选B装置;产生氨气的原因为氢氧化钠溶于水放出大量热,温度升高,使氨的溶解度减小而放出;氧氧化钠吸水,促使氨放出;氢氧化钠电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡左移,导致氨气放出。4中的K2SO4、SiO2、CuO杂质除去并回收得到V2O5的流程为载体考查化学平衡移动原理、物质的分离和提纯、氨气的制备及相关反应方程式的书写。
CaCl2+2H2O+2NH3↑;乙小组用浓氨水和氢氧化钠固体不加热制氨气,应选B装置;产生氨气的原因为氢氧化钠溶于水放出大量热,温度升高,使氨的溶解度减小而放出;氧氧化钠吸水,促使氨放出;氢氧化钠电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡左移,导致氨气放出。4中的K2SO4、SiO2、CuO杂质除去并回收得到V2O5的流程为载体考查化学平衡移动原理、物质的分离和提纯、氨气的制备及相关反应方程式的书写。
练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
 B(g)+C(g) △H=+85.1kJ·mol-1(吸热反应)
B(g)+C(g) △H=+85.1kJ·mol-1(吸热反应) Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表: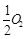 (g)=CO(g)ΔH1=-126.4kJ/mol ①
(g)=CO(g)ΔH1=-126.4kJ/mol ① CH3OH(g)。
CH3OH(g)。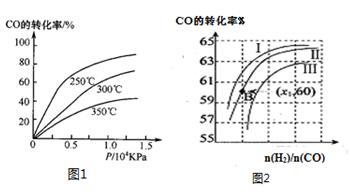
 CH3CHOH+CH3CHOOH。
CH3CHOH+CH3CHOOH。
 2SO3(g) △H<0。2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量Q kJ,则下列分析正确的是
2SO3(g) △H<0。2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量Q kJ,则下列分析正确的是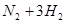

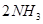 达到平衡的标志是( )。
达到平衡的标志是( )。

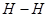 键断裂,同时6mol
键断裂,同时6mol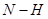 键断裂
键断裂
 2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是
2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是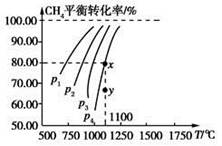
 2C(g)在不同温度和压强时A的转化率如表所示。由此可知,下列图像正确的是
2C(g)在不同温度和压强时A的转化率如表所示。由此可知,下列图像正确的是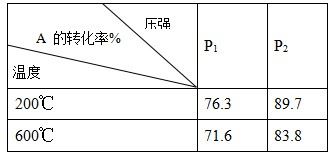

 cC(g) + dD(g) ,反应时间与C%(产物C的体积分数)函数关系如图所示。A图表示的是温度不同的曲线,B图表示压强不同的曲线,C图表示使用催化剂和不使用催化剂时的反应曲线。
cC(g) + dD(g) ,反应时间与C%(产物C的体积分数)函数关系如图所示。A图表示的是温度不同的曲线,B图表示压强不同的曲线,C图表示使用催化剂和不使用催化剂时的反应曲线。