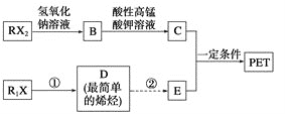
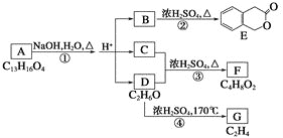
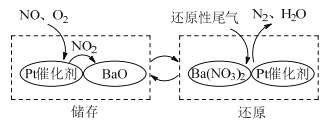
题目内容
【题目】2019年诺贝尔化学奖由来自美、英、日的三人分获,以表彰他们在锂离子电池研究方面做出的贡献,他们最早发明用LiCoO2作离子电池的正极,用聚乙炔作负极。回答下列问题:
(1)基态Co原子价电子排布图为______________(轨道表达式)。第四电离能I4(Co)比I4(Fe)小,是因为_____________________。
(2)LiCl的熔点(605℃)比LiF的熔点(848℃)低,其原因是_________________________.
(3)乙炔(C2H2)分子中δ键与π键的数目之比为_______________。
(4)锂离子电池的导电盐有LiBF4等,碳酸亚乙酯(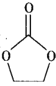 )是一种锂离子电池电解液的添加剂。
)是一种锂离子电池电解液的添加剂。
①LiBF4中阴离子的空间构型是___________;与该阴离子互为等电子体的分子有_____________。(列一种)
②碳酸亚乙酯分子中碳原子的杂化方式有_______________________。
(5)Li2S是目前正在开发的锂离子电池的新型固体电解质,其晶胞结构如图所示,已知晶胞参数a=588pm。
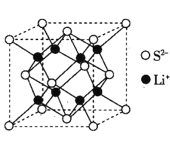
①S2-的配位数为______________。
②设NA为阿伏加德罗常数的值,Li2S的晶胞密度为____________(列出计算式)![]() 。
。
【答案】![]() Co失去的是3d6上的一个电子,而
Co失去的是3d6上的一个电子,而![]() 失去的是半充满状态3d5上的一个电子,故
失去的是半充满状态3d5上的一个电子,故![]() 需要的能量较高 LiCl和LiF均为离子晶体,Cl-半径比F-大,LiCl的晶格能比LiF的小 3:2 正四面体 CF4 sp2、sp3 8
需要的能量较高 LiCl和LiF均为离子晶体,Cl-半径比F-大,LiCl的晶格能比LiF的小 3:2 正四面体 CF4 sp2、sp3 8 ![]()
【解析】
(1)基态Co原子价电子排布式为3d74s2,再得价电子排布图;Co3+为3d6,Fe3+为3d5,Fe3+半满,稳定,难失去电子,因此得到结论。
(2)LiCl与LiF都为离子晶体,主要比较离子晶体中离子半径,键能和晶格能。
(3)乙炔(C2H2)分子中碳碳三键,因此可得分子δ键与π键的数目之比。
(4)①先计算LiBF4中阴离子的电子对,再得空间构型,根据左右价电子联系得出与该阴离子互为等电子体的分子。
②分别分析碳酸亚乙酯分子中每个碳原子的δ键和孤对电子得到结论。
(5)①以最右面中心S2-分析,分析左右连接的锂离子个数。
②先计算晶胞中有几个硫化锂,再根据密度公式进行计算。
(1)基态Co原子价电子排布式为3d74s2,其价电子排布图为![]() ;第四电离能I4(Co)比I4(Fe)小,其Co3+为3d6,Fe3+为3d5,Fe3+半满,稳定,难失去电子,因此原因为Co失去的是3d6上的一个电子,而
;第四电离能I4(Co)比I4(Fe)小,其Co3+为3d6,Fe3+为3d5,Fe3+半满,稳定,难失去电子,因此原因为Co失去的是3d6上的一个电子,而![]() 失去的是半充满状态3d5上的一个电子,故
失去的是半充满状态3d5上的一个电子,故![]() 需要的能量较高,故答案为:
需要的能量较高,故答案为:![]() ;Co失去的是3d6上的一个电子,而
;Co失去的是3d6上的一个电子,而![]() 失去的是半充满状态3d5上的一个电子,故
失去的是半充满状态3d5上的一个电子,故![]() 需要的能量较高。
需要的能量较高。
(2)LiCl的熔点(605℃)比LiF的熔点(848℃)低,它们都为离子晶体,离子晶体熔点主要比较半径,键能和晶格能,因此其原因是LiCl和LiF均为离子晶体,Cl-半径比F-大,LiCl的晶格能比LiF的小,故答案为:LiCl和LiF均为离子晶体,Cl-半径比F-大,LiCl的晶格能比LiF的小。
(3)乙炔(C2H2)分子中碳碳三键,因此分子δ键与π键的数目之比为3:2,故答案为:3:2。
(4)①LiBF4中阴离子的电子对为![]() ,因此空间构型是正四面体型;B-的价电子等于C的价电子,因此与该阴离子互为等电子体的分子有CF4,故答案为:正四面体;CF4。
,因此空间构型是正四面体型;B-的价电子等于C的价电子,因此与该阴离子互为等电子体的分子有CF4,故答案为:正四面体;CF4。
②碳酸亚乙酯分子中碳氧双键的碳原子,δ键有3个,没有孤对电子,因此杂化方式为sp2,另外两个碳原子,δ键有4个,没有孤对电子,因此杂化方式为sp3,所以碳原子的杂化方式有sp2、sp3,故答案为:sp2、sp3。
(5)①以最右面中心S2-分析,连接左边有4个锂离子,右边的晶胞中也应该有4个锂离子,因此配位数为8,故答案为:8。
②设NA为阿伏加德罗常数的值,根据晶胞计算锂离子有8个,硫离子8个顶点算1个,6个面心算3个即总共4个,Li2S的晶胞密度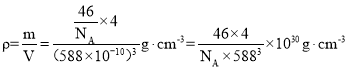 ,故答案为:
,故答案为:![]() 。
。