题目内容
【题目】用下图所示装置分别进行下列实验:将①中溶液滴入②中,按要求填写下列空格:

方案 | ①中物质 | ②中物质 | 填空编号及要求 |
实验1 | 滴加过酚酞的水 | Na2O2 | 写出会看到的现象①_____ |
实验2 | NaOH溶液 | 未打磨过的铝条 | 写出所发生反应的离子方程式 ②_____ |
实验3 | 盐酸 | NaAlO2溶液 | 画出生成沉淀量随盐酸的加入的变化图象 ③_____ |
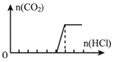
实验4 | 稀盐酸 | Na2CO3与NaOH的混合溶液 | 已知生成气体量随盐酸的加入的变化图象如下,则原溶液中的Na2CO3与NaOH的物质的量浓度之比为 ④_____
|
实验5 | FeCl3和盐酸的混合液 | 等质量的铜、锌、铁三种金属的混合物 | 若反应后无固体剩余,则反应后的溶液中一定存在的阳离子是 ⑤_____ |
【答案】溶液变红色随后褪去 Al2O3+2OH﹣=2AlO2﹣+H2O、2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑  1:4 Fe2+、Zn2+、Cu2+、H+
1:4 Fe2+、Zn2+、Cu2+、H+
【解析】
1.根据过氧化钠和水反应生成氢氧化钠和氧气,氢氧化钠具有碱性,过氧化钠具有强氧化性分析实验现象。
2.根据铝和氧化铝和氢氧化钠的反应分析。
3.根据偏铝酸钠和少量的盐酸反应生成氢氧化铝沉淀,过量的盐酸能溶解氢氧化铝分析图像。
4.根据混合溶液中氢氧化钠先和盐酸反应,然后碳酸钠和盐酸反应生成碳酸氢钠和氯化铵,碳酸氢钠和盐酸再反应生成氯化钠和水和二氧化碳,结合图像数据分析。
5.根据金属性强弱和阳离子的氧化性强弱顺序分析反应的前后顺序。
实验1:过氧化钠和水反应生成氢氧化钠溶液,同时溶液中会生成少量过氧化氢具有氧化性能氧化有机色素,滴加过酚酞的水滴入过氧化钠固体粉碎反应生成氢氧化钠溶液和氧气,溶液变红色,随后红色褪去,
故答案为:溶液变红色随后褪去;
实验2:铝表面有氧化铝是两性氧化物溶于氢氧化钠溶液,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式为:Al2O3+2OH﹣=2AlO2﹣+H2O、2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑,
故答案为:Al2O3+2OH﹣=2AlO2﹣+H2O、2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;
实验3:盐酸滴入偏铝酸钠溶液中先生成氢氧化铝白色沉淀,AlO2﹣+H++H2O=Al(OH)3↓,继续滴加沉淀溶解得到氯化铝溶液,Al(OH)3+3H+=Al3++3H2O,利用化学方程式定量关系,先产生沉淀,后沉淀溶解,所用稀盐酸溶液体积为1:3;绘制沉淀量随盐酸的加入的变化图象为: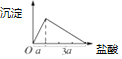 ,
,
故答案为: ;
;
实验4:稀盐酸滴入Na2CO3与NaOH的混合溶液,先和氢氧化钠溶液反应,NaOH+HCl=NaCl+2H2O,随后和碳酸钠溶液反应生成碳酸氢钠,Na2CO3+HCl=NaHCO3+NaCl,继续滴加开始生成二氧化碳气体,NaHCO3+HCl=NaCl+CO2↑+H2O,生成气体的量随盐酸的加入的变化图象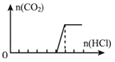 ,分析定量关系得到原溶液中的Na2CO3与NaOH的物质的量浓度之比为:1:4,
,分析定量关系得到原溶液中的Na2CO3与NaOH的物质的量浓度之比为:1:4,
故答案为:1:4;
实验5:FeCl3和盐酸的混合液滴入等质量的铜、锌、铁三种金属的混合物,还原性Zn>Fe>Cu,氧化性Fe3+>H+,氧化还原反应顺序进行,2Fe3++Zn=Zn2++2Fe2+、2Fe3++Fe=3Fe2+、2Fe3++Cu=2Fe2++Cu2+,若反应后无固体剩余,说明氢离子未反应,Fe3+离子可能存在或恰好完全反应,溶液中一定存在Fe2+、Zn2+、Cu2+、H+,
故答案为:Fe2+、Zn2+、Cu2+、H+。

 高中必刷题系列答案
高中必刷题系列答案【题目】下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。已知:2KMnO4+16HCl―→2KCl+5Cl2↑+2MnCl2+8H2O
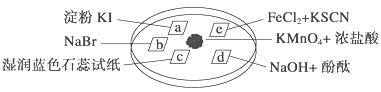
对实验现象的“解释或结论”正确的是 ( )
选项 | 实验现象 | 解释或结论 |
A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
C | d处立即褪色 | 氯气与水生成了漂白性物质 |
D | e处变红色 | 还原性:Fe2+>Cl- |
A. A B. B C. C D. D