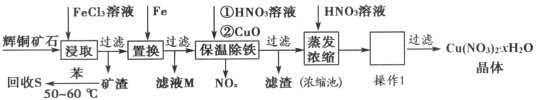
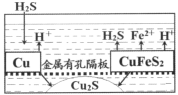
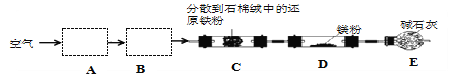
题目内容
【题目】某实验兴趣小组设计如下微型实验装置,a、b为直流电源的两极。实验时,若断开K1,闭合K2,两极均有气泡产生,下列有关描述正确的是( )
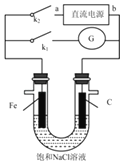
A.断开K1闭合K2时,总反应的离子方程式为:2H++2Cl﹣![]() H2↑+Cl2↑
H2↑+Cl2↑
B.断开K1闭合K2时,电子沿“a→Fe→电解质溶液→C→b”的路径流动
C.断开K2闭合K1时,此时发生的反应类似铁的吸氧腐蚀
D.断开K2闭合K1时,Fe电极被保护,此法称为牺牲阳极的阴极保护法
【答案】C
【解析】
A.断开K1闭合K2时,为惰性电极电解饱和食盐水,总反应的离子方程式为:2Cl﹣+2H2O![]() H2↑+2OH﹣+Cl2↑,故A错误;
H2↑+2OH﹣+Cl2↑,故A错误;
B.断开K1闭合K2时,两极均有气泡产生,说明铁电极是阴极,a是负极、b是正极,电子沿“a→Fe、C→b”的路径流动,电子不能进入溶液,故B错误;
C.断开K2闭合K1时,构成原电池,铁电极为负极,发生金属Fe的吸氧腐蚀,故C正确;
D.断开K2闭合K1时,该装置是原电池,铁易失电子作负极,石墨作正极,金属被腐蚀,故D错误。故选:C。

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
【题目】下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。已知:2KMnO4+16HCl―→2KCl+5Cl2↑+2MnCl2+8H2O
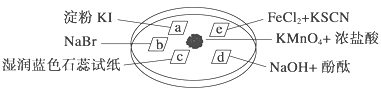
对实验现象的“解释或结论”正确的是 ( )
选项 | 实验现象 | 解释或结论 |
A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
C | d处立即褪色 | 氯气与水生成了漂白性物质 |
D | e处变红色 | 还原性:Fe2+>Cl- |
A. A B. B C. C D. D