题目内容
【题目】随着化工产业的迅猛发展,氯化氢转化为氯气的技术成为科学研究的热点。请按要求回答下列问题:
(1)HCl直接氧化法制Cl2可按下列催化过程进行:
CuCl2(s)=CuCl(s)+1/2Cl2(g) ΔH1 = +83 kJ·mol-1
CuCl(s)+1/2O2(g)=CuO(s)+1/2Cl2(g) ΔH2 = -20 kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3 = -121 kJ·mol-1
写出HCl直接氧化法制Cl2的热化学方程式:____________________________。
(2)在恒定容器中用上述HCl直接氧化法制Cl2,进料c(HCl) ∶c(O2)分别为1:1、4:1、7:1时,HCl平衡转化率随温度变化的关系如下图所示:
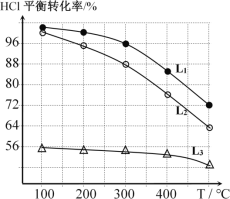
①判断图中c(HCl) /c(O2) = 1:1的曲线为________。
②按化学计量系数比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料时c(HCl)/c(O2)过低、过高的不利影响分别是____________、________。
③综合上述信息,写出在一定温度的条件下进一步提高HCl的转化率的方法: ________________________________________。
④观察上图,以任何一条曲线为例,平衡常数K(200℃)________K(300℃)(填“大于”、“小于”或“等于”)。
⑤设O2初始浓度为c,计算L2对应K(300℃) =____________(列出含c的计算式)。
(3)科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
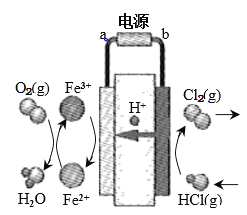
①电源b极为____________极。
②写出阳极区域反应方程式:________________________________________。
③电路中转移1 mol电子时,阳极产生气体体积为__________________L(标准状况)。
【答案】4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ΔH = 116 kJ·mol-1 L1 O2和Cl2分离能耗较高 HCl转化率较低 增加反应体系压强或及时分离出产物 大于 ![]() 正 2HCl2e=Cl2↑+2H+ 11.2
正 2HCl2e=Cl2↑+2H+ 11.2
【解析】
(1)根据盖斯定律,将三个已知的热化学方程式相加即得到目标方程式,目标方程式的焓变等于三个已知方程式的焓变和,相应的热化学方程式为4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ΔH=116kJ·mol-1;
(2)①根据热化学方程式可知,反应物中HCl的占比较高,反应的速率较快,但由于O2为固定值,则HCl的转化率会下降,故L1为1:1条件下的曲线,L2为4:1条件下的曲线,L3为7:1条件下的曲线;
②若比值过低,将反应物和产物分离需要的能耗较高;若比值过高,HCl的转化率较低;
③增大压强平衡正向移动,有助于提高HCl的转化率;减小生成物浓度平衡正向移动,也可提高HCl的转化率,适当降低温度平衡向放热反应即正反应方向进行,有助于提高HCl的转化率;
④当温度升高平衡转化率降低,平衡向逆反应方向移动,反应物浓度升高生成物浓度降低,平衡常数K减小,故K(200℃)大于K(300℃);
⑤300℃时,L2比例HCl的转化率为88%,
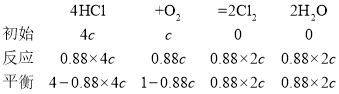
反应动平衡常数K=![]() =
=![]() ;
;
(3)①根据电池示意图,右侧HCl失去电子生成Cl2,为电解池的阳极,故电源b为正极;
②阳极区的电极方程式为2HCl-2e-=Cl2↑+2H+;
③根据阳极的电极方程式,电路中转移1mol电子,反应生成0.5mol Cl2,在标准状况下为11.2L。