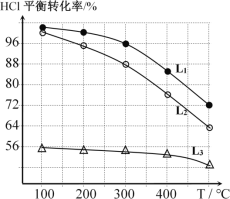
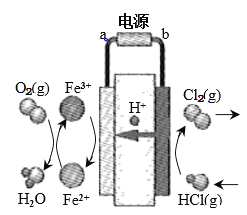
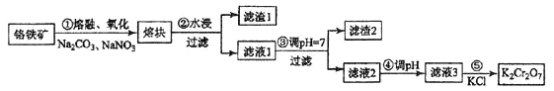
题目内容
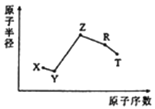
【题目】如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是
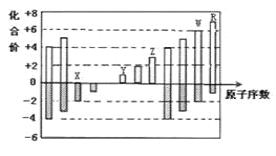
A.原子半径:Z>Y>X
B.Y和Z两者最高价氧化物对应的水化物之间能相互反应
C.WX3和水反应形成的化合物是离子化合物
D.气态氢化物的热稳定性:W>R
【答案】B
【解析】
根据图示,X的化合价只有负价,为O;Y的化合价只有+1价,且原子序数大于O,为Na;同理可知Z为Al;W为S;R为Cl。
A.原子电子层数越多,半径越大,电子层数相同,核电荷数越大,半径越小,所以原子半径:Na>Al>O,A说法错误;
B.Y、Z分别为Na、Al,其最高价氧化物对应水化物分别为氢氧化钠和氢氧化铝,能相互反应,生成偏铝酸钠,B说法正确;
C.SO3和水反应形成硫酸,是共价化合物,C说法错误;
D.非金属性越强,其气态氢化物越稳定,非金属性:Cl>S,气态氢化物的稳定性:HCl>H2S,D说法错误;
答案为B。

【题目】以Na2SO3溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性。
实验 | 试剂 | 现象 | |
滴管 | 试管 | ||
| 0.2 mol·L1Na2SO3溶液 | 饱和Ag2SO4溶液 | Ⅰ.产生白色沉淀 |
0.2 mol·L1CuSO4 | Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀 | ||
0.1 mol·L1Al2(SO4)3溶液 | Ⅲ.开始无明显变化,继续滴加产生白色沉淀 | ||
(1)经检验,现象Ⅰ中的白色沉淀是Ag2SO3。用离子方程式解释现象Ⅰ:____________。
(2)经检验,现象Ⅱ的棕黄色沉淀中不含SO42,含有Cu+、Cu2+和SO32。
已知:Cu+![]() Cu +Cu2+,Cu2+
Cu +Cu2+,Cu2+![]() CuI↓(白色)+I2。
CuI↓(白色)+I2。
①用稀硫酸证实沉淀中含有Cu+的实验现象是_____________。
②通过下列实验证实,沉淀中含有Cu2+和SO32。

a.白色沉淀A是BaSO4,试剂1是____________。
b.证实沉淀中含有Cu+和SO32的理由是___________。
(3)已知:Al2(SO3)3在水溶液中不存在。经检验,现象Ⅲ的白色沉淀中无SO42,该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色。
①推测沉淀中含有亚硫酸根和________。
②对于沉淀中亚硫酸根的存在形式提出两种假设:i.呗Al(OH)3所吸附;ii.存在于铝的碱式盐中。对假设ii设计了对比实验,证实了假设ii成立。
a.将对比实验方案补充完整。

步骤二:_____________(按上图形式呈现)。
(4)根据实验,亚硫酸盐的性质有___________。盐溶液间反应的多样性与__________有关。