题目内容
【题目】在容积为100L的密闭容器中,加入1.0molCH4和2.0molH2O(g).一定条件下发生反应:CH4(g)+H2O(g)CO(g)+3H2(g)△H 已知CH4的转化率与温度、压强的关系如图所示.回答下列问题: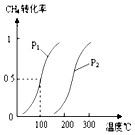
(1)100℃时平衡常数为 .
(2)图中的p1p2(填“<”、“>”或“=”),其理由是:
(3)若100℃时该可逆反应的平衡常数是K1 , 200℃该该可逆反应的平衡常数是K2 , 则K1K2(填“<”、“>”或“=”).其理由是 .
【答案】
(1)2.25×10﹣4 mol2?L﹣2
(2)<;相同温度时p1下CH4的转化率大于p2下CH4的转化率,由反应为气体体积增大的反应,压强越小转化率越高
(3)<;据图象可知,该可逆反应的△H>0,温度升高,平衡正向移动
【解析】解:(1)由图可知,100℃时CH4的转化率为0.5,则
CH4(g)+ | H2O(g) | CO(g)+ | 3H2(g) | |
起始 | 1 | 2 | 0 | 0 |
转化 | 0.5 | 0.5 | 0.5 | 1.5 |
平衡 | 0.5 | 1.5 | 0.5 | 1.5 |
K=  =2.25×10﹣4 mol2L﹣2,
=2.25×10﹣4 mol2L﹣2,
所以答案是:2.25×10﹣4 mol2L﹣2;(2)图中温度相同时,p1对应的转化率大,由反应为气体体积增大的反应,压强越小转化率越高,则p1<p2,
所以答案是:<;相同温度时p1下CH4的转化率大于p2下CH4的转化率,由反应为气体体积增大的反应,压强越小转化率越高;(3)图中压强相同时,温度越高,转化率越大,则该可逆反应的△H>0,温度越高,K越大,则K1<K2,
所以答案是:<;据图象可知,该可逆反应的△H>0,温度升高,平衡正向移动.
【考点精析】利用化学平衡的计算对题目进行判断即可得到答案,需要熟知反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.

 发散思维新课堂系列答案
发散思维新课堂系列答案【题目】t℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)2Z(g),各组分在不同时刻的浓度如表:
物质 | X | Y | Z |
初始浓度/(molL﹣1) | 0.1 | 0.2 | 0 |
2min末浓度/(molL﹣1) | 0.08 | a | b |
平衡浓度/(molL﹣1) | 0.05 | 0.05 | 0.1 |
下列说法正确的是( )
A.平衡时,X的转化率为5%
B.t℃时,该反应的平衡常数为40
C.增大平衡后的体系压强,v(正)增大,v(逆)减小,平衡向正反应方向移动
D.2 min内,用Y的变化量表示的平均反应速率v(Y)=0.03 molL﹣1min﹣1