题目内容
下列排列顺序不正确的是
| A.热稳定性:H2O>NH3>PH3 | B.原子半径:Si>Na>O |
| C.碱性:CsOH>KOH>NaOH | D.失电子能力:K>Na>Mg |
B
解析试题分析:A、非金属性O>N>P,所以热稳定性:H2O>NH3>PH3,正确;B、根据在元素周期表中的位置,可知原子半径:Na>Si>O,错误;C、金属性Cs>K>Na,所以碱性:CsOH>KOH>NaOH,正确;D、金属性K>Na>Mg,所以失电子能力:K>Na>Mg,正确。
考点:本题考查元素周期律及应用。

练习册系列答案
相关题目
X、Y、Z、M、W为短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g/L;W的质子数是X、Y、Z、M四种元素质子数之和的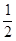 。下列说法正确的是
。下列说法正确的是
| A.原子半径:W>Z>Y>X>M |
| B.由X元素形成的单质不一定是原子晶体 |
| C.XZ2、X2M2、W2Z2均为直线型的共价化合物 |
| D.由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
六种短周期元素(a、b、c、d、e、f)的原子序数依次增大。其中a与e同主族,b与f同主族,e与f同周期;常温下a、e的单质状态不同;d的核电荷数是b的最外层电子数的2倍;单质f是一种重要的半导体材料。由此可推知
| A.a、c两种元素只能组成化学式为ca3的化合物 |
| B.b、c、d分别与a形成的化合物,沸点由高到低依次为:d>c>b |
| C.原子半径由大到小的顺序是 e>f>b>c>a |
| D.元素的非金属性由强到弱的顺序是 d>c>f>b |
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图1所示。下列说法不正确的是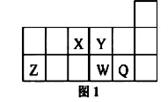
| A.元素X与元素Z的最高正化合价之和的数值等于8 |
| B.Z的氧化物能与水反应 |
| C.离子Y2-和Z 3+的核外电子数和电子层数都相同 |
| D.元素Y的氢化物的稳定性比W的氢化物强 |
元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是( )
| A.若X+和Y2-的核外电子层结构相同,则原子序数:X > Y |
| B.由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S |
| C.硅、锗都位于金属与非金属的交界处,都可以做半导体材料 |
| D.Cs和Ba分别位于第六周期IA和IIA族,碱性:CsOH >Ba(OH)2 |
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是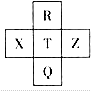
| A.非金属性:Z>T>X |
| B.R与Q的电子数相差26 |
| C.气态氢化物稳定性:R<T<Q |
| D.R、T、Q的最高正价相同 |
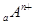 、
、 、
、 、
、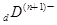 电子层结构相同。关于A、B、C、D四种元素叙述正确的是
电子层结构相同。关于A、B、C、D四种元素叙述正确的是