题目内容
下图为元素周期表中短周期的一部分,下列说法错误的是
| X | Y |
| Z | W |
B.单质的活泼性可能是Y<Z
C.X、Z的最高价氧化物对应水化物可能均为强酸
D.分别由Y、W形成的单质可能都是原子晶体
C
解析试题分析:A、X、Y为O和S,符合要求,正确;B、若YZ分别为氮气和白磷,符合要求,正确;C、错误;D、碳和硅形成的金刚石和晶体硅符合要求,正确。
考点:考查元素周期律和周期表有关问题。

练习册系列答案
相关题目
短周期元素X、Y、Z、W 的原子序数依次增大,且原子最外层电子数之和为13。X 的原子半径比Y 的小,X 与W 同主族,Z 是地壳中含量最高的元素。下列说法不正确的是
| A.原子半径的大小顺序:r(W)>r(Y)>r(Z)>r(X) |
| B.元素Z、W 的简单离子的电子层结构相同 |
| C.元素Y 的简单气态氢化物的热稳定性比Z 的强 |
| D.只含X、Y、Z 三种元素的化合物,可能是离子化合物,也可能是共价化合物 |
X、Y、Z、W是原子序数依次递增的短周期元素,4种元素的原子最外层电子数之和为16,X与
其它元素不在同一周期和同一主族,Y的阴离子与Z的阳离子具有相同的电子层结构,W原子得到一个电子后可形成与某稀有气体原子核外电子排布相同的稳定结构。下列说法合理的是 ( )
| A.简单离子半径:W>Z>Y |
| B.X与Y形成的化合物中,既含极性键又含非极性键的物质至少有2种 |
| C.Z与W形成的化合物一定是离子化合物 |
| D.Y的最高价氧化物对应的水化物的酸性一定比W的弱 |
X、Y、Z、M、W为短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g/L;W的质子数是X、Y、Z、M四种元素质子数之和的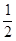 。下列说法正确的是
。下列说法正确的是
| A.原子半径:W>Z>Y>X>M |
| B.由X元素形成的单质不一定是原子晶体 |
| C.XZ2、X2M2、W2Z2均为直线型的共价化合物 |
| D.由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
如图表示1~18号元素原子的结构或性质随核电荷数递增的变化。图中纵坐标表示
| A.电子层数 | B.原子半径 | C.最高化合价 | D.最外层电子数 |
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸,则下列判断正确的是( )。
| A.非金属性:Z<T<X |
| B.R与Q的电子数相差26 |
| C.气态氢化物稳定性:R<T<Q |
| D.最高价氧化物的水化物的酸性:T>Q |
X、Y、Z、W、M五种元素的原子序数依次增大。已知X、Y、Z、W是短周期元素中的四种非金属元素,X元素的原子形成的阴离子核外电子排布与氦原子相同,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍,M是地壳中含量最高的金属元素。下列说法中正确的是( )
| A.五种元素的原子半径从大到小的顺序是:M>W>Z>Y>X |
| B.化合物X2W2、YW2、ZW2等都含有极性共价键和非极性共价键 |
| C.用M单质作阳极,石墨电极作阴极电解NaHCO3溶液,电解一段时间后,在阴极区会出现白色沉淀 |
| D.X、Z两元素能形成原子个数比为3∶1和4∶2的化合物 |
下列判断中一定正确的是( )
| A.若X、Y属于同主族元素,且相对原子质量:X>Y,则X失电子能力比Y强 |
B.若M+和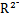 的核外电子层结构相同,则原子半径:R>M 的核外电子层结构相同,则原子半径:R>M |
| C.若X、Y都是气态氢化物,且相对分子质量:X>Y,则酸性:X>Y |
| D.若X、Y是同主族元素,且原子序数:X>Y,则非金属性:X>Y |
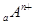 、
、 、
、 、
、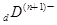 电子层结构相同。关于A、B、C、D四种元素叙述正确的是
电子层结构相同。关于A、B、C、D四种元素叙述正确的是