题目内容
【题目】钴的化合物在磁性材料生产、电池制造、催化剂制备等方面应片非常广泛。
(1)Co2+基态外围电子排布式为______________。
(2)制备[Co(H2O)6]2+反应为(NH4)2[Co(SCN)4]+6H2O=[Co(H2O)6](SCN)2+2NH4SCN。
①配合物[Co(H2O)6]2+中与Co2+形成配位键的原子是_______(填元素符号);SCN-的空间构型为_____(用文字描述)。
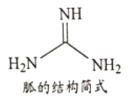
②NH4SCN在180-190℃分解并制得胍(结构简式如下图所示),胍分子中氮原子杂化轨道类型____;lmol胍中含σ键数目为___________。
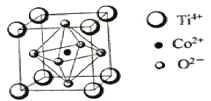
(3)一种钴的化合物可用作石油脱硫的催化剂,其晶胞结构如下图所示,则晶体中与每个O2-紧邻的O2-有________个(填数字)。
【答案】 3d7 O 直线形 sp3和sp2 8mol 8
【解析】 (1)钴是27号元素,所以Co2+基态外围电子排布式为3d7。
(2)①配合物[Co(H2O)6]2+中,水分子是配体,其中O原子有孤电子对,与中心原子Co2+形成配位键的原子是O;SCN-与CO2是等电子体,故其空间构型为直线形。
②由胍的结构简式可知,胍分子中有两种氮原子,每个氮原子都有1个孤电子对,其中两个氨基中的氮原子形成3个σ键,故其杂化轨道类型为sp3,另一个氮原子形成2个σ键和1个π键,其杂化轨道类型为sp2;lmol胍中含σ键数目为8mol。
(3)由晶胞结构示意图可知,晶胞中每个面的面心都有1个O2-,其与晶胞中邻近的4个面的面心上的O2-紧邻,一个面心为2个相邻的晶胞所共用,所以与每个O2-紧邻的O2-有8个。

 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案【题目】常温下,三种难溶电解质的溶度积如下表。
物质 | Ag2CrO4 | AgCl | AgBr |
Ksp | 1.0×10-12 | 1.8×10-10 | 7.7×10-13 |
下列说法正确的是
A. 向饱和AgCl溶液中通入少量HCl气体,溶液中c(Ag+)不变
B. 浓度均为1×10-6 molL﹣1的AgNO3、HBr溶液等体积混合后会生成AgBr沉淀
C. 常温下,以0.01 molL﹣1 AgNO3溶液滴定20mL0.01molL﹣1KCl和0.01molL﹣1K2CrO4的混合溶液,CrO42-先沉淀
D. 常温下,Ag2CrO4(s)+2Cl-(aq)![]() 2AgCl(s)+CrO42-(aq)的平衡常数K=3.1×107
2AgCl(s)+CrO42-(aq)的平衡常数K=3.1×107
