题目内容
5.下列离子方程式中不正确的是( )| A. | 亚硫酸钡与盐酸反应:BaSO3+2H+=Ba2++SO2↑+H2O | |
| B. | 少量二氧化碳通入足量的NaOH溶液:CO2+OH-=HCO${\;}_{3}^{-}$ | |
| C. | 澄清石灰水跟盐酸反应:H++OH-=H2O | |
| D. | 亚硫酸氢钠溶液与NaOH溶液反应:HSO${\;}_{3}^{-}$+OH-=SO${\;}_{3}^{2-}$+H2O |
分析 A.亚硫酸钡为难溶物,离子方程式中需要保留化学式;
B.二氧化碳少量,反应生成碳酸根离子,不是生成碳酸氢根离子;
C.澄清石灰水中的氢氧化钙需要拆开,反应实质为氢离子与氢氧根离子反应生成水;
D.亚硫酸氢钠与氢氧化钠溶液反应生成亚硫酸钠和水.
解答 解:A.亚硫酸钡与盐酸反应生成氯化钡、二氧化硫气体和水,反应的离子方程式为:BaSO3+2H+=Ba2++SO2↑+H2O,故A正确;
B.少量二氧化碳通入足量的NaOH溶液,反应生成碳酸钠和水,反应的离子方程式为:CO2+2OH-=CO32-+H2O,故B错误;
C.澄清石灰水跟盐酸反应的离子方程式为:H++OH-=H2O,故C正确;
D.亚硫酸氢钠溶液与NaOH溶液反应的离子方程式为:HSO3-+OH-=SO32-+H2O,故D正确;
故选B.
点评 本题考查了离子方程式的书写判断,题目难度中等,明确发生反应的实质为解答关键,注意掌握离子方程式的书写原则,B为易错点,注意反应物过量情况对生成物的影响.

练习册系列答案
相关题目
18.下列离子方程式中正确的是( )
| A. | 用FeCl3溶液腐蚀铜制印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| B. | NH4HCO3溶液和过量的NaOH溶液相混合:HCO3-+OH-═CO32-+H2O | |
| C. | 向Fe2(SO4)3的酸性溶液中通入足量H2S:Fe3++H2S═FeS↓+2H+ | |
| D. | FeI2溶液中通入Cl2至I-恰好完全被氧化:2I-+Cl2═I2+2Cl- |
16.下列反应中原子利用率高,符合“绿色化学”要求,无污染环境因素的是( )
| A. | 乙烷与Cl2反应制氯乙烷 | |
| B. | 乙醇和浓硫酸共热制乙烯 | |
| C. | 乙酸和乙醇共热酯化 | |
| D. | 乙烯在催化剂作用下直接氧化制得唯一产物乙醛 |
13.15号元素P在周期表中的位置是( )
| A. | 第二周期第VA族 | B. | 第二周期第VIA族 | C. | 第三周期第VIA族 | D. | 第三周期第VA族 |
20.下列说法正确的是( )
| A. | 同周期主族元素简单离子的半径随核电荷数的增加而减小 | |
| B. | 同主族元素含氧酸的酸性随核电荷数的增加而降低 | |
| C. | 质子数相同的微粒化学性质也相同 | |
| D. | ${\;}_{92}^{235}$U与${\;}_{92}^{238}$U具有相同的核外电子排布 |
10.下列离子方程式书写正确的是( )
| A. | 向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| B. | NaHSO4溶液与Ba(OH)2溶液混合后溶液呈中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| C. | 将标准状况下112mL氯气通入10mL 1mol•L-1的溴化亚铁溶液:2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2 | |
| D. | 等体积、等浓度的Ca(HCO3)2溶液和NaOH溶液混合:Ca2++2HCO3-+2OH-═CaCO3+CO32-+2H2O |
20.在冶金工业上,均不能用通常化学还原剂制得的金属组是( )
| A. | Na、Mg、Al | B. | Na、K、Zn | C. | Fe、Cu、Ag | D. | Na、Ca、K |

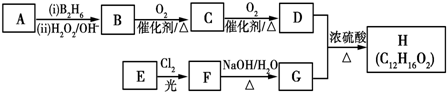
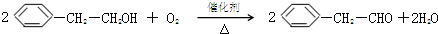 .
. .
.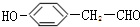 .
.