题目内容
【题目】已知数据:
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 |
乙醇 | -117.3 | 78.5 | 0.789 |
乙酸 | 16.6 | 117.9 | 1.05 |
乙酸乙酯 | -83.6 | 77.5 | 0.90 |
浓硫酸(98%) | — | 338.0 | 1.84 |
实验室制取乙酸乙酯的主要步骤如下:①在30 mL的大试管A中按体积比1∶4∶4的比例配制浓硫酸、乙醇和乙酸的混合溶液;②按图1连接好装置(装置气密性良好),用小火均匀地加热装有混合液的大试管3~5 min;③待试管B收集到一定量产物后停止加热,撤去试管B并用力振荡,然后静置分层;

图1
④分离出乙酸乙酯层、洗涤和干燥。
请根据题目要求回答下列问题:
(1)写出制取乙酸乙酯的化学方程式:________________________________________________________________________。
(2)上述实验中饱和碳酸钠溶液的作用是______(填字母代号)。
A.反应掉乙酸和乙醇
B.反应掉乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中的更小,有利于分层析出
D.加速酯的生成,提高其产率
(3)步骤②中需要用小火均匀加热,其主要原因是________________________________________________________________________。
(4)某化学课外小组设计了图2所示的制取乙酸乙酯的装置(铁架台、铁夹、加热装置均已略去),
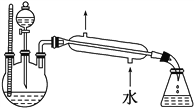
图2
与图1所示装置相比,此装置的主要优点有________________________________________________________________。
【答案】 CH3COOH+C2H5OH![]() CH3COOC2H5+H2O BC 减少原料损失,减少副产物 增加了温度计,有利于控制发生装置中反应液的温度;②增加了分液漏斗,有利于及时补充反应混合液,以提高乙酸乙酯的产量;③增加了冷凝装置,有利于收集产物乙酸乙酯
CH3COOC2H5+H2O BC 减少原料损失,减少副产物 增加了温度计,有利于控制发生装置中反应液的温度;②增加了分液漏斗,有利于及时补充反应混合液,以提高乙酸乙酯的产量;③增加了冷凝装置,有利于收集产物乙酸乙酯
【解析】(1)实验室利用无水乙醇和乙酸在浓硫酸的催化下加热制得乙酸乙酯,制取乙酸乙酯的化学方程式为:CH3COOH+C2H5OH![]() CH3COOC2H5+H2O; (2)饱和碳酸钠溶液的作用主要有3个:①使混入乙酸乙酯中的乙酸与Na2CO3反应而除去,②使混入的乙醇溶解.③使乙酸乙酯的溶解度减小,减少其损耗及有利于它的分层和提纯.答案选BC;(3)由题中给出的各物质的主要物理性质,根据各物质的沸点数据可知,乙酸(117.9℃)、乙醇(78.0℃)的沸点都比较低,且与乙酸乙酯的沸点(77.5℃)比较接近,若用大火加热,反应物容易随生成物(乙酸乙酯)一起蒸出来,导致原料的大量损失;另一个方面,温度太高,可能发生其他副反应;(4)图2与图1所示装置相比,此装置的主要优点有增加了温度计,有利于控制发生装置中反应液的温度;②增加了分液漏斗,有利于及时补充反应混合液,以提高乙酸乙酯的产量;③增加了冷凝装置,有利于收集产物乙酸乙酯。
CH3COOC2H5+H2O; (2)饱和碳酸钠溶液的作用主要有3个:①使混入乙酸乙酯中的乙酸与Na2CO3反应而除去,②使混入的乙醇溶解.③使乙酸乙酯的溶解度减小,减少其损耗及有利于它的分层和提纯.答案选BC;(3)由题中给出的各物质的主要物理性质,根据各物质的沸点数据可知,乙酸(117.9℃)、乙醇(78.0℃)的沸点都比较低,且与乙酸乙酯的沸点(77.5℃)比较接近,若用大火加热,反应物容易随生成物(乙酸乙酯)一起蒸出来,导致原料的大量损失;另一个方面,温度太高,可能发生其他副反应;(4)图2与图1所示装置相比,此装置的主要优点有增加了温度计,有利于控制发生装置中反应液的温度;②增加了分液漏斗,有利于及时补充反应混合液,以提高乙酸乙酯的产量;③增加了冷凝装置,有利于收集产物乙酸乙酯。