题目内容
某离子化合物的晶胞如右图所示立体结构,晶胞是整个晶体中最基本的重复单位。小黑球表示阳离子,小白球表示阴离子,该离子化合物中,阴、阳离子个数比是
| A.1∶8 | B.1∶4 | C.1∶2 | D.1∶1 |
D
解析试题分析:该晶胞中阴离子个数为12×1/4+1=4个,阳离子个数为8×1/8+6×1/2=4。故,阴阳离子个数比为1:1,选择D
考点:晶胞的计算

练习册系列答案
 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案
相关题目
氮氧化铝(AlON)属原子晶体,是一种超强透明材料,下列描述错误的是( )
| A.AlON和石英的化学键类型相同 |
| B.AlON和石英晶体类型相同 |
| C.AlON和(工业上通过电解法制备铝用的)Al2O3的化学键类型不同 |
| D.AlON和(工业上通过电解法制备铝用的)Al2O3晶体类型相同 |
有关晶体的下列说法中正确的是
| A.晶体中分子间作用力越大,分子越稳定 |
| B.原子晶体中共价键越强,熔点越高 |
| C.冰熔化时水分子中共价键发生断裂 |
| D.氯化钠熔化时离子键未被破坏 |
只含非金属元素的晶体描述正确的是
| A.有可能是金属晶体 | B.有可能是离子晶体 |
| C.一定是分子晶体 | D.一定不是原子晶体 |
最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性,因这三种元素都是常见元素,从而引起广泛关注。该新型超导晶体的一个晶胞如图所示,则该晶体的化学式为
| A.Mg2CNi3 | B.MgCNi3 | C.MgCNi2 | D.MgC2Ni |
下列说法正确的是
| A.Mg2+的半径小于N3-的半径 |
| B.H2O比H2S稳定是因为H2O中存在分子间氢键 |
| C.SiO2因的相对分子质量大于CO2,所以SiO2的熔点高于CO2 |
| D.由原子构成的晶体一定是原子晶体 |
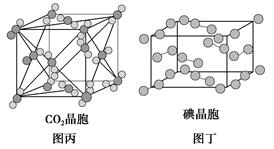
有关晶体的结构如图所示,下列说法中不正确的是( )。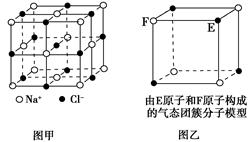
| A.在NaCl晶体(图甲)中,距Na+最近的Cl-形成正八面体 |
| B.该气态团簇分子(图乙)的分子式为EF或FE |
| C.在CO2晶体(图丙)中,一个CO2分子周围有12个CO2分子紧邻 |
| D.在碘晶体(图丁)中,碘分子的排列有两种不同的方向 |
关于晶体的自范性,下列叙述正确的是( )。
| A.破损的晶体能够在固态时自动变成规则的多面体 |
| B.缺角的氯化钠晶体在饱和的NaCl溶液中慢慢变为完美的立方块 |
| C.圆形容器中结出的冰是圆形的 |
| D.由玻璃制成的圆形的玻璃球 |
