题目内容
下列图示内容的对应说明错误的是
A
解析试题分析:100ml容量瓶只能配制100ml的溶液,不能配制200毫升的溶液。故A错
考点:考查化学实验的相关知识点。

练习册系列答案
相关题目
某离子化合物的晶胞如右图所示立体结构,晶胞是整个晶体中最基本的重复单位。小黑球表示阳离子,小白球表示阴离子,该离子化合物中,阴、阳离子个数比是
| A.1∶8 | B.1∶4 | C.1∶2 | D.1∶1 |
决定物质性质的重要因素是物质结构。请回答下列问题。
(1)下图是石墨的结构,其晶体中存在的作用力有 (填序号) 
A:σ键 B:π键 C:氢键 D:配位键 E:分子间作用力 F:金属键 G:离子键
(2) 下面关于晶体的说法不正确的是___________
| A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4 |
| B.硬度由大到小:金刚石>碳化硅>晶体硅 |
| C.熔点由高到低:Na>Mg>Al |
| D.晶格能由大到小:NaF> NaCl> NaBr>NaI |

图Ⅰ 图Ⅱ 图Ⅲ
① 图I所示的晶体中与Ca2+离子最近且等距离的Ca2+离子数为 ,
图III中未标号的Cu原子形成晶体后周围最紧邻的Cu原子数为 ;
② H3BO3晶体中B原子杂化方式______ ; CNO-的形状为____________;
③ 三种晶体中熔点高低的顺序为 (填空化学式),
H3BO3晶体受热熔化时,克服的微粒之间的相互作用为
(4) 碳的某种单质的晶胞如右图所示,一个晶胞中有_____个碳原子;若该晶体的密度为ρ g/cm3,阿伏加德罗常数的值为NA,则晶体中最近的两个碳原子之间的距离为_ ____cm(用代数式表示)

已知:HCN(aq)与NaOH(aq)反应的ΔH=-12.1kJ·mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-55.6kJ·mol-1。则HCN在水溶液中电离的ΔH等于( )
| A.+43.5kJ·mol-1 | B.-43.5kJ·mol-1 | C.+67.7kJ·mol-1 | D.-67.7kJ·mol-1 |
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ?ΔH =+49.0 kJ/mol
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) ?ΔH=-192.9 kJ/mol
根据上述反应,下列说法正确的是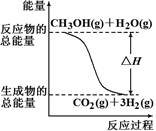
| A.反应①中的能量变化如上图所示 |
| B.可推知2H2(g)+O2(g)=2H2O(g)?ΔH=-483.8 kJ/mol |
| C.1 mol CH3OH充分燃烧放出的热量为192.9 kJ |
| D.CH3OH转变成H2的过程一定要吸收能量 |
氢气和氟气混合在黑暗处即可发生爆炸而释放出大量的热量。在反应过程中,断裂1molH2中的化学键消耗的能量为Q1kJ,断裂1molF2中的化学键消耗的能量为Q2kJ,形成1molHF中的化学键释放的能量为Q3kJ。下列关系式中正确的是
| A.Q1+ Q2<2Q3 | B.Q1+ Q2>2Q3 | C.Q1+ Q2<Q3 | D.Q1+ Q2>Q3 |
下列热化学方程式中,正确的是( )
| A.甲烷的燃烧热为 890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3 kJ·mol-1 |
| B.500℃、30MPa 下,将 0.5mol N2(g)和 1.5molH2(g)置于密闭容器中充分反应生成 NH3(g)放热 19.3 kJ,其热化学方程式为: N2(g)+3H2(g)  2NH3(g) △H = -38.6 kJ·mol-1 2NH3(g) △H = -38.6 kJ·mol-1 |
| C.HCl 和 NaOH 反应的中和热△H =" -57.3" kJ·mol-1, 则 H2SO4和 Ca(OH)2反应的中和热 △H = 2×(-57.3)kJ·mol -1 |
| D.在 101 kPa 时,2gH2完全燃烧生成液态水,放出 285.8kJ 热量,氢气燃烧的热化学方程式表示为 2H2(g)+O2(g)=2H2O(1)△H = -571.6 kJ·mol-1 |
同温同压下,已知下列各反应均为放热反应,其中放热最少的是( )
| A.2A ( l ) + B ( l ) =" 2C" ( g ) ΔH1 | B.2A ( g ) + B ( g ) =" 2C" ( g ) ΔH2 |
| C.2A ( g ) + B ( g ) =" 2C" ( l ) ΔH3 | D.2A ( l ) + B ( l ) =" 2C" ( l ) ΔH4 |
