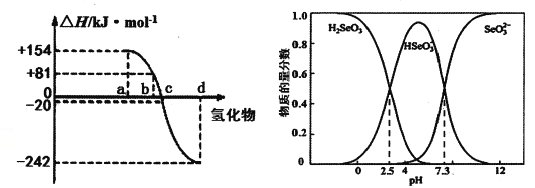
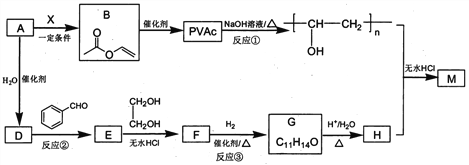
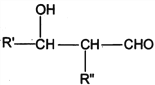
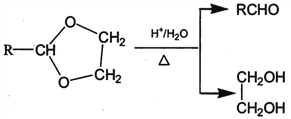
题目内容
【题目】在一定条件下,Na2CO3溶液存在水解平衡:CO![]() +H2O
+H2O![]() HCO
HCO![]() +OH-。下列说法正确的是( )
+OH-。下列说法正确的是( )
A. 稀释溶液,水解平衡常数增大
B. 加入少量NH4Cl固体,平衡朝正反应方向移动
C. 升高温度,![]() 减小
减小
D. 加入NaOH固体,溶液pH减小
【答案】B
【解析】A.水解平衡常数只与温度有关,与溶液的浓度无关,A不正确;B. 加入少量NH4Cl固体,铵根离子可以结合水电离的OH-,使溶液中的OH-浓度减小,从而使碳酸根离子的水解平衡朝正反应方向移动,B正确;C. 升高温度,碳酸根离子的水解程度增大,碳酸根离子的浓度减小、碳酸氢根离子的浓度增大,故![]() 增大,C不正确;D. 加入NaOH固体,由于其为强碱且不与碳酸钠反应,故溶液pH增大,D不正确。本题选B。
增大,C不正确;D. 加入NaOH固体,由于其为强碱且不与碳酸钠反应,故溶液pH增大,D不正确。本题选B。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】从某含Br—废水中提取Br2的过程包括:过滤、氧化、萃取(需选择合适萃取剂)及蒸馏等步骤。已知:
物质 | Br2 | CCl4 | 正十二烷 |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |
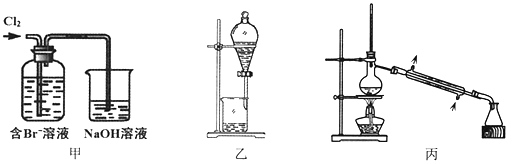
下列说法不正确的是
A. 甲装置中Br—发生的反应为:2Br-+ Cl2 = Br2 + 2Cl-
B. 甲装置中NaOH溶液每吸收0.1mol Cl2,转移0.1mol e—
C. 用乙装置进行萃取,溶解Br2的有机层在下层
D. 用丙装置进行蒸馏,先收集到的是Br2
【题目】为测定铝热反应实验所得“铁块”的成分,某学生兴趣小组设计实验流程如图所示。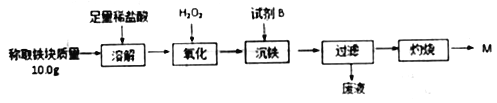
几种氢氧化物开始沉淀和完全沉淀的pH如下表所示。
Fe2+ | Fe3+ | Al3+ | Mg2+ | |
开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
(1)取溶解操作得到的溶液,向其中滴加KSCN溶液,发现溶液变血红色。出现这种现象的原因,除了可能混有没反应完的氧化铁外,还有一个原因是_______________。
(2)沉铁操作应调节溶液pH的范围的为________,试剂B 选择______。(填序号)
a.稀盐酸 b.氧化铁 c.MgCO3固体 d.氨水
(3)已知常温下Fe(OH)3的Ksp=1.1×10-36,则铁完全沉淀时溶液中c(Fe3+)=_____mol/L。
(4)根据流程得到的固体M质量_____(填“能”或“不能”)计算出铁块中金属铁的质量,原因是________________。
(5)另有小组采用滴定的方式测定“铁块”中铁的含量(铁元素只存在Fe和Fe2O3),测定方式如下:
I.取10g“铁块”粉碎,加入足量氢氧化钠溶液充分反应,过滤、洗涤、干燥,得到8.88g固体。将固体加入足量盐酸溶解,获得200mL溶液A;
II.取出10mL 溶液A 于锥形瓶,先加入足量的SnCl2溶液,将Fe3+全部转化为Fe2+,除去过量的Sn2+;
III.加入一定量的硫酸和磷酸,并滴加指示剂。再向锥形瓶中滴加0.1000mol/LK2Cr2O7溶液,恰好完全反应时,共消耗12.50mL K2Cr2O7溶液。发生反应:Cr2O72-+6Fe2++14H+==2Cr3++6Fe3++7H2O
①步骤I中加入足量氢氧化钠溶液的作用为________________________。
②请计算样品中Fe单质的质量分数__________(写出计算过程)。