题目内容
【题目】回答下列问题:
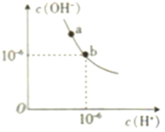
(1)某温度(t℃)时,水的电离图象如下图所示,a点水的离子积Kw=_____该温度下,pH=11的NaOH溶液与pH=2的H2SO4溶液等体积混合,溶液显_____(填“酸”或“碱”)性。
(2)25℃时,向0.1molL-1的氨水中加入少量NH4Cl固体,当固体溶解后,测得溶液pH_____(填“增大”“减小”或“不变”,下同),![]() 的物质的量浓度_____
的物质的量浓度_____
(3)将体积相等的NaOH稀溶液和CH3COOH溶液混合,若溶液中c(Na+)=c(CH3COO-),则该溶液显_____(填“酸性”“碱性”或“中性”),则混合前c(NaOH)_____(填“>”“<”或“=”)c(CH3COOH)
(4)常温下,Ksp[Fe(OH)3]=1×10-38,要使溶液中的Fe3+沉淀完全[残留在溶液中的c(Fe3+)<10-5molL-1],则溶液的pH应大于_____
(5)用可溶性碳酸盐,可以浸取CaSO4固体,在溶液浸取过程中会发生反应:CaSO4(s)+![]() (ag)CaCO3(s)+
(ag)CaCO3(s)+![]() (aq)。已知:298K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,则此温度下该反应的平衡常数K为_____(计算结果保留三位有效数字)。
(aq)。已知:298K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,则此温度下该反应的平衡常数K为_____(计算结果保留三位有效数字)。
【答案】1.0×10-12 碱 减小 增大 中性 < 3 1.75×104
【解析】
(1)根据图知,当c(H+)=10-6mol/L,c(OH-)=10-6mol/L,离子积常数Kw=c(H+)×c(OH-)=10-6×10-6=10-12,pH=2的H2SO4溶液中c(H+)= 0.01mol/L, pH = 12的NaOH中c(OH-)=![]() =1mol/L,等体积混合时碱过量,溶液呈碱性;
=1mol/L,等体积混合时碱过量,溶液呈碱性;
(2)一水合氨为弱电解质,溶液中存在电离平衡NH3H2O![]()
![]() +OH-,向氨水中加入氯化铵时,溶液中
+OH-,向氨水中加入氯化铵时,溶液中![]() 浓度增大,抑制一水合氨电离,溶液中氢氧根离子浓度减小,则pH减小;
浓度增大,抑制一水合氨电离,溶液中氢氧根离子浓度减小,则pH减小;
(3)溶液中存在电荷守恒c(Na+) + c(H+) = c(CH3COO-) + c(OH-),由于c(Na+) = c(CH3COO-),所以c(OH-)=c(H+),所以溶液呈中性;醋酸钠溶液呈碱性,要使醋酸和氢氧化钠的混合溶液呈中性,则醋酸应该稍微过量,因为二者的体积相等,所以醋酸的浓度大于氢氧化钠;
(4)常温时,Fe(OH)3的Ksp=1×10-38,要使溶液中的Fe3+沉淀完全,残留在溶液中的c(Fe3+)<10-5molL-1;若c(Fe3+)=10-5molL-1,Ksp=c(Fe3+)c3(OH-)=10-5×c3(OH-)=1×10-38,c(OH-)=10-11mol/L,c(H+)=![]() mol/L =10-3mol/L,溶液pH=3,则溶液的pH应大于3;
mol/L =10-3mol/L,溶液pH=3,则溶液的pH应大于3;
(5)溶浸过程中会发生:CaSO4(s)+![]() (ag)CaCO3(s)+
(ag)CaCO3(s)+![]() (aq),CaCO3(s) =Ca2++
(aq),CaCO3(s) =Ca2++![]() ; CaSO4(s) = Ca2++
; CaSO4(s) = Ca2++![]() ;依据硫酸钙、碳酸钙溶度积常数的计算表达式,转化关系中钙离子相同计算,反应的平衡常数
;依据硫酸钙、碳酸钙溶度积常数的计算表达式,转化关系中钙离子相同计算,反应的平衡常数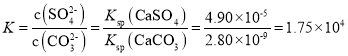 。
。

 巧学巧练系列答案
巧学巧练系列答案【题目】下表是![]() 时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是
时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是
化学式 | AgCl |
|
| HClO |
|
Ksp或Ka |
|
|
|
|
|
A.相同浓度![]() 和NaClO的混合液中,各离子浓度的大小关系是
和NaClO的混合液中,各离子浓度的大小关系是![]()
B.向![]() 溶液中滴加NaOH溶液至
溶液中滴加NaOH溶液至![]() :
:![]() :9,此时溶液
:9,此时溶液![]()
C.碳酸钠溶液中滴加少量氯水的离子方程式为![]()
D.向浓度为![]() 的KCl和
的KCl和![]() 混合液中滴加
混合液中滴加![]() 的
的![]() 溶液,
溶液,![]() 先形成沉淀。
先形成沉淀。
【题目】根据要求完成下列各小题:
Ⅰ.(1)理论上稀的强酸、强碱反应生成1molH2O(l)时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式__________________________。
(2)已知:乙苯催化脱氢制苯乙烯反应:![]() +H2(g)
+H2(g)
化学键 | C-H | C-C | C=C | H-H |
键能/kJmol-1 | 412 | 348 | 612 | 436 |
计算上述反应的△H=_________kJmol-1。
Ⅱ.25℃时,部分物质的电离平衡常数如表所示,请回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为_____________________________。
(2)将少量CO2气体通入NaClO溶液中,写出反应的离子方程式:____________________。
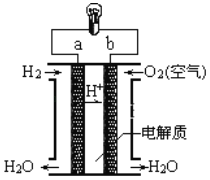
【题目】如图所示,某化学兴趣小组设计了一个燃料电池,并探究氯碱工业原理和粗铜精炼原理,其中乙装置中X为阳离子交换膜。根据要求回答相关问题:

(1)通入氧气的电极为_____(填“正极”或“负极”),通氢气一极的电极反应式为_________________;
(2)铁电极为_______(填“阳极”或“阴极”),乙装置中电解反应的化学方程式为_________________。
(3)若在标准状况下,有1.12 L氧气参加反应,丙装置中阴极增重的质量为______g;
(4)某粗铜中含有铁、金、银和铂等杂质,通过电解精制后,为从电解液中制得硫酸铜晶体(CuSO4·5H2O),设计了如下工艺流程:

已知:几种金属阳离子开始沉淀和沉淀完全的pH:
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Fe3+ | 1.9 | 3.2 |
Fe2+ | 7.0 | 9.0 |
Cu2+ | 4.7 | 6.7 |
①步骤I中加入试剂A的目的是_____________________________,试剂A应选择______(填序号);
a.氯气 b.过氧化氢 C.酸性高锰酸钾溶液
选择该试剂的原因_____________________________________________________;
②步骤II中试剂B为_________,调节pH的范围是___________;
③步骤III的操作是加热浓缩、_______、___________。