题目内容
7.现有部分短周期元素的性质或原子结构如下表:| 元素编号 | 元素性质或原子结构 |
| X | X+具有与Ne原子相同的电子层结构 |
| Y | 最外层电子数是次外层的一半,其最高正价与最低负价的绝对值相等 |
| Z | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| T | 元素单质的颜色是黄绿色的气体 |
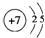 .
.(2)X元素与T元素形成化合物的电子式是
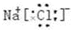 .
.(3)X的最高价氧化物对应水化物的化学式是NaOH,化学键类型有离子键、共价键.
(4)Y和Z的最高价氧化物对应的水化物中酸性较强的是HNO3(填化学式)写出可以验证该结论的一个简单易行的实验方案向Na2SiO3溶液中滴加HNO3溶液,产生白色沉淀.
分析 短周期元素中,X+具有与Ne原子相同的电子层结构,则X为Na;Y元素原子的最外层电子数是次外层的一半,其最高正价与最低负价的绝对值相等,则Y为Si元素;常温下Z元素单质为双原子分子,其氢化物水溶液呈碱性,则Z为N元素;T元素单质的颜色是黄绿色的气体,则T为Cl,据此解答.
解答 解:短周期元素中,X+具有与Ne原子相同的电子层结构,则X为Na;Y元素原子的最外层电子数是次外层的一半,其最高正价与最低负价的绝对值相等,则Y为Si元素;常温下Z元素单质为双原子分子,其氢化物水溶液呈碱性,则Z为N元素;T元素单质的颜色是黄绿色的气体,则T为Cl.
(1)Y为Si元素,在周期表中的位置是第3周期第ⅣA族,Z为N元素,原子结构示意图是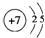 ,
,
故答案为:第3周期第ⅣA族;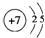 ;
;
(2)X元素与T元素形成化合物为NaCl,电子式是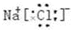 ,故答案为:
,故答案为: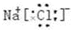 ;
;
(3)X的最高价氧化物对应水化物的化学式是NaOH,含有离子键、共价键,故答案为:NaOH;离子键、共价键;
(4)硝酸的酸性比硅酸酸性强,验证该结论的一个简单易行的实验方案为:向Na2SiO3溶液中滴加HNO3溶液,产生白色沉淀,
故答案为:HNO3;向Na2SiO3溶液中滴加HNO3溶液,产生白色沉淀.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意金属性、非金属性强弱比较实验事实,难度不大.

练习册系列答案
相关题目
17.下列关于有机化合物的说法中,正确的是( )
| A. | 有机物都不是电解质 | |
| B. | 所有的有机化合物都很容易燃烧 | |
| C. | 有机物中一定含有C元素,也可含H、N、S等元素 | |
| D. | 易溶于汽油、酒精、苯等有机溶剂的物质一定是有机化合物 |
18.在120℃时,某混合烃和过量O2在一密闭容器中完全反应,恢复到120℃时,测知反应前后的压强没有变化,则该混合烃可能是( )
| A. | CH4和C2H4 | B. | CH4和C2H6 | C. | C2H4和C2H6 | D. | C3H4和C3H6 |
15.下列描述中,前者一定大于后者的( )
| A. | 22.4LCO2与11.2LCO气体所含的分子数 | |
| B. | 放热反应中,反应物的总能量与生成物的总能量 | |
| C. | 0.2mol/LNaOH与0.1mol/LNa2CO3溶液中Na+的物质的量浓度 | |
| D. | 1mol水分子与1mol铵根离子中含有的电子数 |
2.用氯气消毒过的自来水配制下列溶液时,会使配得的溶液变质的是( )
①NaOH ②AgNO3 ③Na2CO3 ④FeCl2.
①NaOH ②AgNO3 ③Na2CO3 ④FeCl2.
| A. | ②④ | B. | ①②③ | C. | ①③ | D. | ①②③④ |
12.把金属A放入盐B(NO3)2的溶液中,发生如下反应:发生如下反应:A+B2+═A2++B,以下说法正确的是( )
| A. | 常温下金属A一定能与水反应,B一定不能与水反应 | |
| B. | A与B用导线连接后放入酒精中,一定形成原电池 | |
| C. | A与B用导线连接后放入B(NO3)2的溶液中,一定有电流产生 | |
| D. | 由A与B形成的原电池,A一定是负极,B一定是正极 |
11.下列有关热化学方程式的叙述正确的是( )
| A. | 已知C(石墨,s)=C(金刚石,s)△H>O,则金刚石比石墨稳定 | |
| B. | 已知2H2(g)+O2(g)═2H20(1)△H=-571.6kJ•mol-1,则氢气的燃烧热为-285.8kJ•mol-1 | |
| C. | 含20.0 gNaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该条件下稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)═H3COOHNa(aq)+H2O(l)H=-57.4kJ•mol-1 | |
| D. | 已知2C(s)+2O2(g)=2CO2(g)△H1:2C(s)+O2(g)═2CO(g)△H2 则△H1>△H2 |
 .
.