题目内容
【题目】氯乙烯是合成聚氯乙烯的单体,制取氯乙烯的方法有乙炔加成法、乙烯氧氯化法等。
(1)乙炔加成法包含的主要反应如下:
CaO+3C![]() CaC2+CO↑
CaC2+CO↑
CaC2+2H2O→Ca(OH)2+HC≡CH↑
HC≡CH+HCl![]() CH2=CHCl
CH2=CHCl
①CaC2的电子式为__________。
②该方法具有设备简单、投资低、收率高等优点;其缺点是_________________(列举2点)。
(2)乙烯氧氯化法包含的反应如下:
CH2=CH2(g)+Cl2(g)→ClCH2-CH2Cl(g) △H1
2CH2=CH2(g)+4HCl(g)+O2(g)→2ClCH2-CH2Cl(g)+2H2O(g)△H2
ClCH2-CH2Cl(g)→CH2=CHCl(g)+HCl(g)△H3
总反应:4CH2=CH2(g)+2Cl2(g)+O2(g)→4CH2=CHCl(g)+2H2O(g) △H4
则△H4=__________(用含△H1、△H2、△H3 的代数式表示)。
(3)将一定量的1,2-二氯乙烷充入密闭容器中,发生反应:ClCH2-CH2Cl(g)→CH2=CHCl(g)+HCl(g),两 种 物 质 的物 质 的 量分数 (w) 与 温度的关系如图所示。
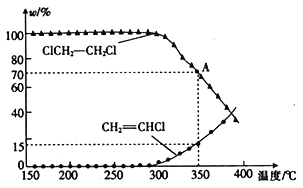
①温度低于290℃时,氯乙烯的产率为0,其原因是______________________;该反应的△H________(填“>”或“<”) 0。
②已知A点的总压强为101kPa,则A点对应温度下的平衡常数Kp=_______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,保留小数点后两位数字)。
③不考虑反应的选择性,若要进一步提高氯乙烯的平衡产率,则可以采取的措施是_____________(任写两条)。
【答案】 ![]() 耗能大、原料成本高(或催化剂氯化汞毒性大等合理答案) 2△H1+△H2+4△H3 1,2-二氯乙烷未开始裂解(或其他合理答案) > 3.25 kPa 减小体系的总压强、及时移出氯乙烯(或将HCl溶解除去或升高温度)
耗能大、原料成本高(或催化剂氯化汞毒性大等合理答案) 2△H1+△H2+4△H3 1,2-二氯乙烷未开始裂解(或其他合理答案) > 3.25 kPa 减小体系的总压强、及时移出氯乙烯(或将HCl溶解除去或升高温度)
【解析】(1) ① CaC2是离子化合物,由乙炔的结构可推知乙炔钙的电子式为![]() ;② 该方法的缺点是耗能大、原料成本高、催化剂毒性大等;
;② 该方法的缺点是耗能大、原料成本高、催化剂毒性大等;
(2)根据已知的三个反应,利用盖斯定律① ×2+② +③×4即得总反应,所以△H4=2△H1+△H2 + 4△H3;
(3) ①温度低于290℃时,氯乙烯的产率为0,可能是温度低,1,2-二氯乙烷分子没有达到活化分子所需要的最低能量,所有的化学键都没有断裂,因此氯乙烯的产率为0;该反应为分解反应,所以是吸热反应,即△H>0;② 设1,2-二氯乙烷的起始物质的量为1mol, 根据A点对应的两物质的分数可得n(ClCH2-CH2Cl)= ![]() mol,n(CH2=CHCl) =n(HCl) =
mol,n(CH2=CHCl) =n(HCl) = ![]() mol,即n总=
mol,即n总= ![]() mol,所以p(ClCH2-CH2Cl)=101 kPa×0.7=70.7 kPa,p(CH2=CHCl)= 101 kPa×0.15=15.15 kPa=p(HCl),所以Kp =
mol,所以p(ClCH2-CH2Cl)=101 kPa×0.7=70.7 kPa,p(CH2=CHCl)= 101 kPa×0.15=15.15 kPa=p(HCl),所以Kp = ![]() =
= ![]() = 3.25 kPa;③ 为了进一步提高氯乙烯的产率,由于该反应是气体体积增大的反应,可适当减小体系的总压强,或及时移出产物氯乙烯,或将HCl溶解而除去,或根据图象也可以适当升高温度。
= 3.25 kPa;③ 为了进一步提高氯乙烯的产率,由于该反应是气体体积增大的反应,可适当减小体系的总压强,或及时移出产物氯乙烯,或将HCl溶解而除去,或根据图象也可以适当升高温度。

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案