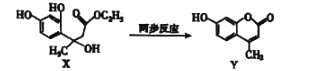
题目内容
【题目】用惰性电极电解足量的Cu(NO3)2溶液,下列说法中正确的是( )
A. 阳极发生的电极反应为Cu2++2e﹣═Cu
B. 阴极发生的电极反应为4OH﹣﹣4e﹣═2H2O+O2↑
C. 若有6.4g金属Cu析出,生成的O2一定为0.05mol
D. 电解完成后,加入一定量的Cu(OH)2,溶液可能恢复到原来的浓度
【答案】C
【解析】
用惰性电极电解足量的Cu(NO3)2溶液,阳极氢氧根离子失电子发生氧化反应,阴极为铜离子得电子发生还原反应。
A、用惰性电极电解足量的Cu(NO3)2溶液,阳极氢氧根离子失电子发生氧化反应,反应式为4OH--4e-=2H2O+O2↑,故A错误;
B、阴极为铜离子得电子发生还原反应,反应式为Cu2++2e-=Cu,故B错误;
C、根据阴极上发生电极反应:Cu2++2e-=Cu,有6.4g金属Cu析出,阴极消耗铜离子的物质的量为0.1mol,转移电子数为0.2moL,生成的O2一定为0.05mol,故C正确;
D、用惰性电极电解足量的Cu(NO3)2溶液,2Cu2++2H2O![]() 2Cu+O2↑+4H+,应加入一定量的CuO,溶液可能恢复到原来的浓度,故D错误。
2Cu+O2↑+4H+,应加入一定量的CuO,溶液可能恢复到原来的浓度,故D错误。
故选C。

练习册系列答案
相关题目
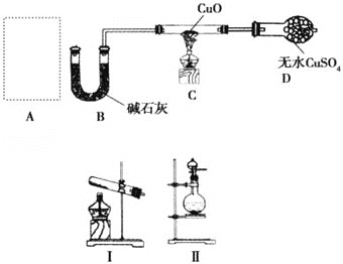
【题目】用石墨电极完成下列电解实验
实验一 | 实验二 | |
装置 |
|
|
现象 | a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近有气泡产生;n处有气泡产生…… |
下列对实验现象的解释或推测不合理的是( )
A. a、d处:2H2O+2e-=H2↑+2OH- B. b处:2Cl--2e-=Cl2↑
C. c处发生了反应:Fe-2e-=Fe2+ D. 根据实验一的原理,实验二中m处能析出铜