题目内容
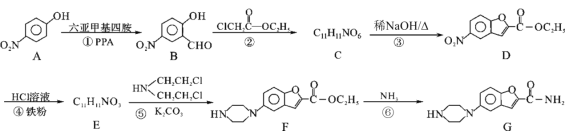
【题目】实验室制取乙酸乙酯,如图所示实验装置:

请回答下列问题:
(1)能完成本实验的装置是 __________________(从甲、乙、丙中选填)
(2)试管B中装入的液体为 ______________。
(3)制取乙酸乙酯时加入试剂顺序为_____________________,发生反应的化学方程式为 __________________________________________。
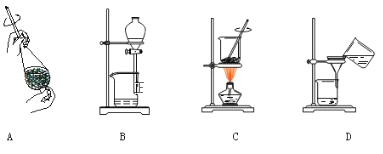
(4)从制备乙酸乙酯所得的混合物中分离、提纯乙酸乙酯时,需要经过多步操作,下列图示的操作中,肯定需要的化学操作是___________(选填答案编号)。
(5)用30g乙酸和40g乙醇反应,可以得到37.4g乙酸乙酯,则该实验的产率(产率指的是某种生成物的实际产量与理论产量的比值)是 ____________。
【答案】乙、丙 饱和Na2CO3溶液 将浓H2SO4加入乙醇中,边加边振荡,最后加入乙酸(按乙醇、浓硫酸、乙酸顺序即可) CH3COOH+HOCH2CH3 ![]() CH3COOCH2CH3+H2O A、B 85%
CH3COOCH2CH3+H2O A、B 85%
【解析】
(1)甲中导管在液面下可发生倒吸,而乙和丙均可防止倒吸,乙和丙可顺利完成实验,故答案为:乙、丙;
(2)乙酸乙酯在饱和碳酸钠溶液中溶解度较小,且可除去乙酸、乙醇,试管B中装入的液体为饱和Na2CO3溶液;
(3)加入药品时应注意防止酸液飞溅,可将浓H2SO4加入乙醇中,边加边振荡,最后加入乙酸,催化条件下,乙酸、乙醇发生酯化反应生成乙酸乙酯,方程式为CH3COOH+HOCH2CH3 ![]() CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;
(4)从混合物中分离出乙酸乙酯,要用萃取、分液的方法,故选用A、B两装置,故答案为:A、B;
(5)30g乙酸的物质的量为![]() =0.5mol,40g乙醇的物质的量为
=0.5mol,40g乙醇的物质的量为![]() mol=0.87mol,根据反应方程式CH3COOH+HOCH2CH3
mol=0.87mol,根据反应方程式CH3COOH+HOCH2CH3 ![]() CH3COOCH2CH3+H2O,可知乙醇过量,
CH3COOCH2CH3+H2O,可知乙醇过量,
设乙酸乙酯的理论产量为m,则
CH3COOH+HOCH2CH3 ![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
60 88
30g m
故m=![]() =44g,
=44g,
则产率为![]() ×100%=85%。
×100%=85%。

 计算高手系列答案
计算高手系列答案【题目】有五种短周期元素,它们的结构、性质等信息如下表所述:
元素 | 结构、性质等信息 |
A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
B | B与A同周期,其最高价氧化物的水化物呈两性 |
C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
E | L层上有2对成对电子 |
请根据表中信息填空:
(1)A原子的核外电子排布式为___________。
(2)B元素在周期表中的位置:__________________;离子半径:B___ A(填“大于”或“小于”)
(3)C原子的价电子排布图是___________,其原子核外有__________个未成对电子,能量最高的电子为___________轨道上的电子,其轨道呈___________形。
(4)D原子的电子排布式为___________。D-的结构示意图是________________
(5)C、E元素的第一电离能的大小关系是___________(用元素符号表示)。
(6)已知CD3分子中D元素为+1价,则C、D的电负性大小关系是________________(用元素符号表示),CD3与水反应后的产物是__________和__________。