题目内容
【题目】硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放。某校兴趣小组欲测定硫酸工业尾气中二氧化硫的含量,采用以下方案:
甲方案:如图所示,图中气体流量计B用于准确测量通过尾气的体积。将尾气通入一定体积已知浓度的碘水中测定SO2的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。

(1)碘水吸收二氧化硫的离子方程式为___。
(2)洗气瓶C中的溶液可以用其他试剂替代,请你举出一种:___。
(3)洗气瓶C溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量___(填“偏高”、“偏低”或“无影响”)。
乙方案:实验步骤如图流程图所示:
![]()
(4)写出步骤①中反应的化学方程式___。
(5)写出步骤②中反应的离子方程式___。
(6)该尾气中二氧化硫的体积分数为___(气体体积已换算成标准状况,用含有V、m的代数式表示)。
【答案】SO2+I2+2H2O= 4H++SO42-+2I- 酸性高锰酸钾溶液(或溴水) 偏低 SO2+H2O2=H2SO4 2OH-+2H++Ba2++SO42- =2H2O+BaSO4↓ ![]()
【解析】
(1)碘水和二氧化硫发生氧化还原反应生成硫酸和碘化氢,离子方程式为SO2+I2+2H2O= 4H++SO42-+2I-,
答案为:SO2+I2+2H2O= 4H++SO42-+2I-;
(2)洗气瓶C中的溶液还可以用酸性高锰酸钾溶液、溴水等代替,
答案为:酸性高锰酸钾溶液(或其他合理答案);
(3)洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,则通入尾气的体积增大,因此SO2含量偏低,
答案为:偏低;
(4)尾气中的二氧化硫与双氧水反应,生成硫酸,化学方程式SO2+H2O2=H2SO4,
答案为:SO2+H2O2=H2SO4;
(5)乙方案利用的原理为![]() ,
,![]() 。步骤②中反应的离子方程式为2OH- + 2H+ + Ba 2+ + SO42- = 2H2O + BaSO4↓;
。步骤②中反应的离子方程式为2OH- + 2H+ + Ba 2+ + SO42- = 2H2O + BaSO4↓;
答案为:2OH- + 2H+ + Ba 2+ + SO42- = 2H2O + BaSO4↓;
(6)根据![]() ,
,![]() 可得,
可得,![]() ,根据硫元素守恒,则尾气中二氧化硫的体积为
,根据硫元素守恒,则尾气中二氧化硫的体积为![]() ,故尾气中二氧化硫的含量为
,故尾气中二氧化硫的含量为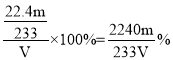 。
。
答案为:![]() 。
。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案