题目内容
【题目】在25℃时,H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH变化关系如下图所示,下列叙述错误的是
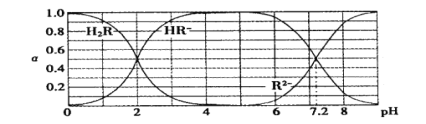
A.H2R是二元弱酸,其Ka1=1×10-2
B.当溶液恰好呈中性时,c( Na + )=2c ( R2- ) + c( HR- )
C.NaHR在溶液中水解倾向大于电离倾向
D.含Na2R与NaHR各0.1 mol的混合溶液的pH=7.2
【答案】C
【解析】
试题分析:A.根据图像可知,在溶液中存在H2R、HR-、R2-,说明H2R是弱酸。当溶液的pH=2时,c(H+)=c(HR-)=1×10-2mol/L,c(HR-)=c(H2R) 1×10-2mol/L ,所以H2R是二元弱酸,其![]() Ka1=1×10-2,正确;B.根据电荷守恒可得:c( Na + )+ c(H+)= c(OH-)+2c ( R2- ) + c( HR- ),当溶液恰好呈中性时,c(H+)= c(OH-),所以c( Na + )=2c ( R2- ) + c( HR- )。正确;C.NaHR是强碱弱酸盐,在溶液中HR-电离使溶液显酸性,HR-水解使溶液显碱性。根据图像显示可知在溶液中HR-电离倾向大于水解倾向,所以溶液显酸性,错误; D.含Na2R与NaHR各0.1 mol的混合溶液,即二者的物质的量分数相等时,根据图像可知此时溶液的pH=7.2,正确。
Ka1=1×10-2,正确;B.根据电荷守恒可得:c( Na + )+ c(H+)= c(OH-)+2c ( R2- ) + c( HR- ),当溶液恰好呈中性时,c(H+)= c(OH-),所以c( Na + )=2c ( R2- ) + c( HR- )。正确;C.NaHR是强碱弱酸盐,在溶液中HR-电离使溶液显酸性,HR-水解使溶液显碱性。根据图像显示可知在溶液中HR-电离倾向大于水解倾向,所以溶液显酸性,错误; D.含Na2R与NaHR各0.1 mol的混合溶液,即二者的物质的量分数相等时,根据图像可知此时溶液的pH=7.2,正确。

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
