题目内容
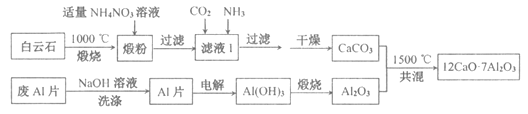
【题目】七铝十二钙![]() 是新型的超导材料和发光材料。用白云石(主要含
是新型的超导材料和发光材料。用白云石(主要含![]() 和
和![]() )和废
)和废![]() 片制备七铝十二钙的工艺如下:
片制备七铝十二钙的工艺如下:
请按要求回答下列问题:
(1)煅粉主要含![]() 和______。
和______。
(2)废铝片用![]() 溶液洗涤时往往有气泡产生,原因是(用离子方程式表示)__________。
溶液洗涤时往往有气泡产生,原因是(用离子方程式表示)__________。
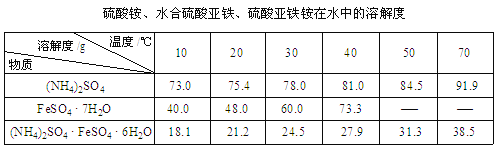
(3)该工艺中浸取煅粉不能用![]() 替代
替代![]() 的原因是________________________。
的原因是________________________。
![]() 溶液显酸性,用化学用语表示其原因: ________________________。
溶液显酸性,用化学用语表示其原因: ________________________。
(4)若向滤液Ⅰ中通入过量![]() ,发生反应的化学方程式为________________________,从而会导致
,发生反应的化学方程式为________________________,从而会导致![]() 产率降低。
产率降低。
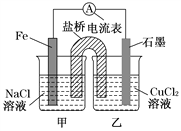
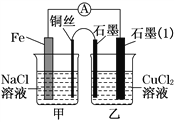
(5)电解制备![]() 时,电极分别为
时,电极分别为![]() 片和石墨,电解质溶液为
片和石墨,电解质溶液为![]() 溶液,阳极材料为___。
溶液,阳极材料为___。
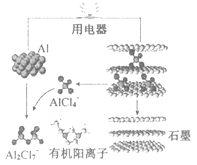
(6)科研人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用![]() 和有机阳离子构成电解质溶液,其放电工作原理如图所示。则放电时负极电极反应式为________________________。
和有机阳离子构成电解质溶液,其放电工作原理如图所示。则放电时负极电极反应式为________________________。
【答案】![]()
![]()
![]() 溶液与
溶液与![]() 可以生成
可以生成![]() 沉淀,造成钙元素的损失 NH4++H2O
沉淀,造成钙元素的损失 NH4++H2O![]() NH3·H2O+H+
NH3·H2O+H+ ![]()
![]()
![]()
【解析】
白云石煅烧发生反应:CaCO3![]() CaO+CO2↑,MgCO3
CaO+CO2↑,MgCO3![]() MgO+CO2↑,在锻粉中加入适量的NH4NO3溶液后,镁化合物几乎不溶,由于NH4NO3溶液水解显酸性,与CaO反应生成Ca(NO3)2和NH3H2O,故过滤后溶液中含Ca(NO3)2和NH3H2O,将CO2和NH3通入滤液I中后发生反应:Ca(NO3)2+2NH3+CO2+H2O=CaCO3↓+2NH4NO3,若滤液Ⅰ中仅通入CO2,会造成CO2过量。废铝片加入氢氧化钠溶液反应生成偏铝酸钠溶液,用NaOH溶液可除去废Al片表面的氧化膜,电解制备Al(OH)3时,电极分别为Al片和石墨,在碳酸钠溶液中搅拌电解,得到氢氧化铝,过滤加热灼烧得到氧化铝,碳酸钙和氧化铝共混加热1500℃得到七铝十二钙。
MgO+CO2↑,在锻粉中加入适量的NH4NO3溶液后,镁化合物几乎不溶,由于NH4NO3溶液水解显酸性,与CaO反应生成Ca(NO3)2和NH3H2O,故过滤后溶液中含Ca(NO3)2和NH3H2O,将CO2和NH3通入滤液I中后发生反应:Ca(NO3)2+2NH3+CO2+H2O=CaCO3↓+2NH4NO3,若滤液Ⅰ中仅通入CO2,会造成CO2过量。废铝片加入氢氧化钠溶液反应生成偏铝酸钠溶液,用NaOH溶液可除去废Al片表面的氧化膜,电解制备Al(OH)3时,电极分别为Al片和石墨,在碳酸钠溶液中搅拌电解,得到氢氧化铝,过滤加热灼烧得到氧化铝,碳酸钙和氧化铝共混加热1500℃得到七铝十二钙。
(1)白云石主要含CaCO3和MgCO3,煅烧时发生反应:CaCO3![]() CaO+CO2↑,MgCO3
CaO+CO2↑,MgCO3![]() MgO+CO2↑,所以煅烧后的固体煅粉中主要含MgO和CaO;
MgO+CO2↑,所以煅烧后的固体煅粉中主要含MgO和CaO;
(2)Al可以与强碱NaOH溶液发生反应,产生偏铝酸钠和氢气,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
(4)在该工艺中浸取煅粉不能用(NH4)2SO4替代NH4NO3是因为(NH4)2SO4会与其中的CaO反应产生微溶于水的CaSO4,造成Ca元素的流失;NH4NO3是强酸弱碱盐,NH4+水解消耗水电离产生的OH-,使溶液中c(OH-)减小,最终达到平衡时c(H+)>c(OH-),溶液显酸性,水解的离子方程式为NH4++H2O![]() NH3·H2O+H+;
NH3·H2O+H+;
(5)电解制备Al(OH)3时,电极分别为![]() 片和石墨,电解质溶液为Na2CO3溶液,Al反应后元素化合价升高,所以Al电极为阳极。
片和石墨,电解质溶液为Na2CO3溶液,Al反应后元素化合价升高,所以Al电极为阳极。
(6)科研人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用![]() 和有机阳离子构成电解质溶液,根据放电工作原理图所示,可知:在放电时Al失去电子,与其中的AlCl4-结合形成Al2Cl7-,负极电极反应式为Al-3e-+7AlCl4-=4Al2Cl7-。
和有机阳离子构成电解质溶液,根据放电工作原理图所示,可知:在放电时Al失去电子,与其中的AlCl4-结合形成Al2Cl7-,负极电极反应式为Al-3e-+7AlCl4-=4Al2Cl7-。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案