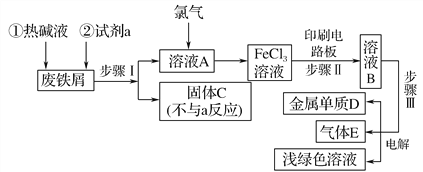
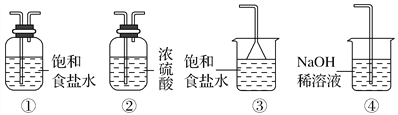
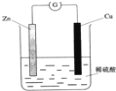
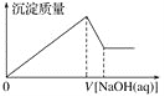
��Ŀ����
����Ŀ����ʽ̼����þ[MgaAlb(OH)c(CO3)d��xH2O]������������ȼ����
(1)��ʽ̼����þ������ȼ���ã������������ȷֽ������մ���������________��
(2)MgaAlb(OH)c(CO3)d��xH2O��a��b��c��d�Ĵ�����ϵʽΪ________��
(3)Ϊȷ����ʽ̼����þ����ɣ���������ʵ�飺
��ȷ��ȡ3.390 g��Ʒ������ϡ�����ַ�Ӧ������CO2 0.560 L(�ѻ���ɱ�״����)��
����ȡһ������Ʒ�ڿ����м��ȣ���Ʒ�Ĺ��������(![]() ��100%)���¶ȵı仯����ͼ��ʾ(��Ʒ��270 ��ʱ����ȫʧȥ�ᾧˮ��600 �����ϲ�������Ϊ����������Ļ����)��
��100%)���¶ȵı仯����ͼ��ʾ(��Ʒ��270 ��ʱ����ȫʧȥ�ᾧˮ��600 �����ϲ�������Ϊ����������Ļ����)��
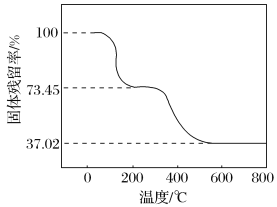
��������ʵ�����ݼ����ʽ̼����þ��Ʒ�е�n(OH�� )��n(CO32- ) _________________ (д���������)��
���𰸡����ɵIJ��������ȼ����2a��3b��c��2d3��5
��������
(1)��ʽ̼����þ[MgaAlb(OH)c(CO3)dxH2O]���ȷֽ���������MgO��Al2O3��MgO��Al2O3���۵�ϸ��Ҷ���ȼ�գ���������ȼ���ã��ʴ�Ϊ�����ɵIJ��������ȼ���ã�
(2)�������и�Ԫ�ػ��ϼ۵Ĵ�����Ϊ0������2a+3b+c+4d=(c+3d)��2�����Ե�2a+3b=c+2d���ʴ�Ϊ��2a+3b=c+2d��
(3)n(CO2)= ![]() =2.50��10-2mol��m(CO2)=2.50��10-2mol��44g/mol=1.10g����270�桫600��֮�䣬ʧȥ�ᾧˮ�����Ʒ��һ�����ȷֽ�����CO2��H2O��m(CO2)+m(H2O)=3.390g��(0.7345-0.3702)=1.235g��m(H2O)=1.235g-1.10g=0.135g��n(H2O)=
=2.50��10-2mol��m(CO2)=2.50��10-2mol��44g/mol=1.10g����270�桫600��֮�䣬ʧȥ�ᾧˮ�����Ʒ��һ�����ȷֽ�����CO2��H2O��m(CO2)+m(H2O)=3.390g��(0.7345-0.3702)=1.235g��m(H2O)=1.235g-1.10g=0.135g��n(H2O)=![]() =7.50��10-3 mol���ٸ�����ԭ���غ��n(OH-)=2n(H2O)=1.50��10-2 mol������Cԭ���غ��n(CO32-)=n(CO2)=2.50��10-2mol������n(OH-)��n(CO32-)=1.50��10-2 mol��2.50��10-2mol=3��5���𣺼�ʽ̼����þ��Ʒ�е�n(OH-)��n(CO32-)=3��5��
=7.50��10-3 mol���ٸ�����ԭ���غ��n(OH-)=2n(H2O)=1.50��10-2 mol������Cԭ���غ��n(CO32-)=n(CO2)=2.50��10-2mol������n(OH-)��n(CO32-)=1.50��10-2 mol��2.50��10-2mol=3��5���𣺼�ʽ̼����þ��Ʒ�е�n(OH-)��n(CO32-)=3��5��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ�������仯�����ת������Դ���úͻ�����������Ҫ�о����⡣
��1���ϳɰ���ҵ���������������֮һ�����ǻ��ʹ�ҵ�ͻ����л���������Ҫԭ�ϡ� �ϳɰ���Ӧ���йػ�ѧ�������������±���
��ѧ�� | H��H | N��N | N��H |
E/ kJmol��1 | 436 | 946 | 391 |
����֪���ϳɰ���Ӧ��N2(g)+3H2(g)![]() 2NH3(g)�Ļ��Ea=508 kJmol��1���ֽⷴӦ��2NH3(g)
2NH3(g)�Ļ��Ea=508 kJmol��1���ֽⷴӦ��2NH3(g)![]() N2(g)+3H2(g)�Ļ��Ea=_____��
N2(g)+3H2(g)�Ļ��Ea=_____��
����ͼ��ʾ500�桢60.0MPa�����£�ԭ����Ͷ�ϱ���ƽ��ʱNH3��������Ĺ�ϵ������ͼ��a�����ݼ���N2��ƽ�����������_____������3λ��Ч���֣���

�������¶ȶԺϳɰ���Ӧ��Ӱ�죬��ͼ����ϵ�У�����һ�������µ��ܱ������ڣ���ͨ��ԭ������ʼ�����¶Ȳ���������N2���ʵ����仯������ʾ��ͼ_______________��

��2��ѡ���Դ���ԭ��������(SCr)��Ŀǰ�ϳ�������������������ü�����ָ���¶�300~420��֮��ʹ��������£��û�ԭ��(��NH3)ѡ���Ե���NOx��Ӧ��
��SCr���������з�������Ҫ��ӦΪ��4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g)��H=��1625.5kJ��mol��1��������[n(NH3)��n(NO)]��ֱ��Ӱ��÷����������ʡ�350��ʱ��ֻ�ı䰱����Ͷ������������ת�����백���ȵĹ�ϵ��ͼ��ʾ����n(NH3)��n(NO)��1.0ʱ��������NOŨ�ȷ���������Ҫԭ����_____��
4N2(g)+6H2O(g)��H=��1625.5kJ��mol��1��������[n(NH3)��n(NO)]��ֱ��Ӱ��÷����������ʡ�350��ʱ��ֻ�ı䰱����Ͷ������������ת�����백���ȵĹ�ϵ��ͼ��ʾ����n(NH3)��n(NO)��1.0ʱ��������NOŨ�ȷ���������Ҫԭ����_____��

��������Һ���������еĵ�������Ҳ��һ�������ķ�����д��NO2��Na2CO3��Һ�������������εĻ�ѧ��Ӧ����ʽ_____��
��ֱ�ӵ������Ҳ��������������6����ϡ��������NOx���������ᣬ�ٽ�����Һ������۵�⣬ʹ֮ת��Ϊ���ᡣ���װ����ͼ��ʾ�������ĵ缫��ӦʽΪ_____��

����Ŀ�����ڱ�ǰ�����ڵ�Ԫ��a��b��c��d��e��ԭ��������������a��b�����������������Ԫ�أ�c�ǵؿ��к�������Ԫ�أ�d��bͬ�壬e2+���ӵ�3d�������9�����ӡ��ش��������⣺
��1��c��d����Ԫ���γɵĻ�����ͳ�ƹ�ʯ����ͨ��______________����������ᾧ�κ����ε����ִ�����̬��c�ĵ����Ų�ͼΪ_______________________��
��2��A��B�����������ֳ������л��A����CaCO3��Ӧ�������ڳ�����ˮ����B�����е�̼ԭ����Ŀ��A����ͬ���ɷ���������Ӧ��A�д��ڻ�ѧ����������______��
A.���Ӽ� B.���Լ� C.�Ǽ��Լ� D.�Ҽ� E.�м�
B���ӹ�������̼ԭ�ӵĹ���ӻ�������____��
��3���á�>����<����գ�
��һ������ | �۵� |
b___d | dc2����___d���� |
��4��c��e����Ԫ�ؿ��γ�һ�ְ뵼����ϣ���ѧʽΪe2c���������������ڲ����ĸ�cԭ�ӣ�����cԭ��λ�����ĺͶ��㣬��þ�������____��eԭ�ӣ�eԪ��λ��Ԫ�����ڱ���_______����
��5����e2+�����ε�ˮ��Һ�м�������İ�ˮ���ɵõ�����ɫ����Һ�������Ҵ�����������ɫ���壬����д������������ӷ���ʽ___________________��
��6��e����Ϊ�����������壬��ԭ�Ӱ뾶Ϊrcm���侧���ⳤΪa nm����e���ʵ��ܶ�Ϊ__________g��cm-3����ռ������ʵļ���ʽΪ_______________________��