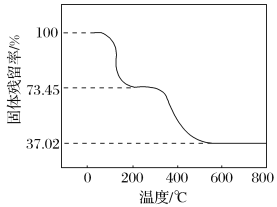
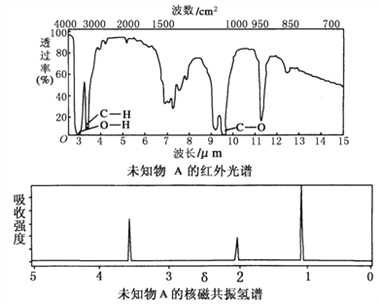
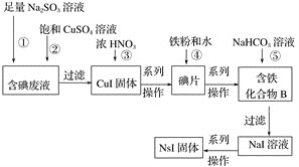
题目内容
【题目】周期表前四周期的元素a、b、c、d、e,原子序数依次增大,a和b是组成物质种类最多的元素,c是地壳中含量最多的元素,d与b同族,e2+离子的3d轨道中有9个电子。回答下列问题:
(1)c、d两种元素形成的化合物统称硅石,可通过______________方法区分其结晶形和无定形的两种存在形态,c的电子排布图为_______________________。
(2)A和B是生活中两种常见的有机物,A能与CaCO3反应,可用于厨房除水垢;B分子中的碳原子数目与A中相同,可发生银镜反应。A中存在化学键的类型是______;
A.离子键 B.极性键 C.非极性键 D.σ键 E.π键
B分子官能团中碳原子的轨道杂化类型是____。
(3)用“>”或“<”填空:
第一电离能 | 熔点 |
b___d | dc2晶体___d晶体 |
(4)c与e两种元素可形成一种半导体材料,化学式为e2c,在其立方晶胞内部有四个c原子,其余c原子位于面心和顶点,则该晶胞中有____个e原子,e元素位于元素周期表的_______区。
(5)向e2+硫酸盐的水溶液中加入过量的氨水,可得到深蓝色透明溶液,加入乙醇可析出深蓝色晶体,请书写析出晶体的离子方程式___________________。
(6)e单质为面心立方晶体,其原子半径为rcm,其晶胞棱长为a nm,则e单质的密度为__________g·cm-3,其空间利用率的计算式为_______________________。
【答案】X-射线衍射实验![]() BCDEsp2 >>16ds[Cu(NH3)4]2++SO42-+H2O= [Cu(NH3)4] SO4·H2O↓p=
BCDEsp2 >>16ds[Cu(NH3)4]2++SO42-+H2O= [Cu(NH3)4] SO4·H2O↓p=![]()
![]() ×100%
×100%
【解析】
周期表前四周期的元素a、b、c、d、e,原子序数依次增大,a和b是组成物质种类最多的元素,a为氢,b为碳; c是地壳中含量最多的元素,c为氧;d与b同族,d为硅;e2+离子的3d轨道中有9个电子,其原子核外电子排布式为: 1s22s22p63s23p63d104s1,核电荷数为29,该元素为铜;
(1)c、d两种元素形成的化合物为二氧化硅,可通过X-射线衍射实验方法区分其结晶形和无定形的两种存在形态;c为氧元素,核电荷数为8,,电子排布图为![]() ;正确答案: X-射线衍射实验 ;
;正确答案: X-射线衍射实验 ; ![]() 。
。
(2)A为有机物,A能与CaCO3反应,可用于厨房除水垢,所以A为醋酸;B分子中的碳原子数目与A中相同,可发生银镜反应,B为甲酸甲酯;醋酸的结构为CH3COOH,所以A中存在化学键的类型有:极性键、非极性键、σ键、π键;B分子结构简式为HCOOCH3,其官能团为酯基:-COO-,碳原子的轨道杂化数=0+3=3,属于sp2杂化;正确答案:BCDE; sp2 。
(3)一般规律:同一主族从上到下,第一电离能逐渐减小,因此第一电离能:碳大于硅; 二氧化硅、硅均为原子晶体,但因Si-O键的键能大于 Si-Si键的键能,键能越大,熔点越高,所以熔点二氧化硅大于晶体硅;正确答案:>;>。
(4)晶胞中含有氧原子数为1/8×8+1/2×6+4=8.则该晶胞中铜原子数是氧原子数的2倍,即16个;根据铜元素原子排布:1s22s22p63s23p63d104s1,铜元素位于元素周期表ds的区;正确答案:16;ds。
(5)乙醇的极性小于水,在溶液中加入乙醇能够减小溶剂的极性,降低[Cu(NH3)4] SO4溶解度;所以向硫酸铜溶液中加入乙醇可析出深蓝色晶体为[Cu(NH3)4] SO4·H2O;离子方程式:[Cu(NH3)4]2++SO42-+H2O=[Cu(NH3)4] SO4·H2O↓;正确答案:[Cu(NH3)4]2++SO42-+H2O= [Cu(NH3)4] SO4·H2O↓。
(6)铜单质为面心立方晶体,含有铜原子数为8×1/8+6×1/2=4,其相对质量为4×64,该晶胞的体积为V=(a×10-7)3cm3,晶胞的密度为ρ=m/V=4×64/NA×(a×10-7)3=![]() g·cm-3;1个晶胞中铜原子的体积为4×4πr3/3 cm3 ,晶胞的体积为(a×10-7)3cm3,根据晶胞的结构可知,a=2
g·cm-3;1个晶胞中铜原子的体积为4×4πr3/3 cm3 ,晶胞的体积为(a×10-7)3cm3,根据晶胞的结构可知,a=2![]() r×10-7cm,所以,空间利用率的计算式为(4×4πr3/3)/(2
r×10-7cm,所以,空间利用率的计算式为(4×4πr3/3)/(2![]() r)3=
r)3=![]() ×100%;正确答案:p=
×100%;正确答案:p=![]() ;
;![]() ×100%。
×100%。

【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NO2反应进行了探究。回答下列问题:
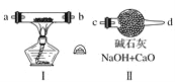
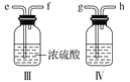
(1)用消石灰和氯化铵固体制备NH3
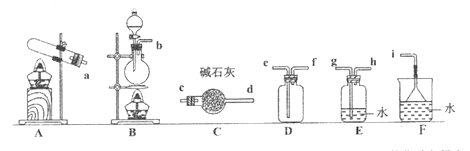
①NH3的发生装置应选择上图中的_______(填序号),制备NH3的化学方程式为______。
②欲收集一瓶干燥的NH3,选择上图中的装置,其连接顺序为:发生装置→_________(按气流方向,用小写字母表示)。
(2)研究NH3与NO2的反应
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。
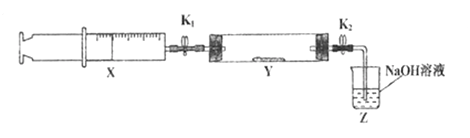
操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢充入Y管中 | ①Y管中__________ | ②反应的化学方程式 _______________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝聚 |
打开K2 | 溶液倒吸入Y管 | ③________________ |