题目内容
9.H2O2是在医疗、化工方面应用广泛的化学试剂.(1)Na2O2、CaO2以及BaO2都可与酸作用生成过氧化氢,实验室通过上述某种过氧化物与适量稀硫酸作用,过滤后即可制得较纯净的H2O2溶液,则应选择的过氧化物是BaO2;
(2)实验室可用H2O2与次氯酸钠反应制氧气,其中还原剂是H2O2,写出该反应的化学方程式H2O2+NaClO=H2O+NaCl+O2↑,生成0.5mol氧气,转移电子1mol;
(3)用酸性高锰酸钾溶液滴定法可测定双氧水中H2O2的含量,5H2O2+2KMnO4+3H2SO4=2MnSO4+K2SO4+5O2↑+8H2O,滴定终点的现象是溶液由无色变成紫红色,且在半分钟内溶液颜色不褪去,某次滴定中消耗0.50mol/L的高锰酸钾溶液40.00ml,则此双氧水溶液中溶质的质量为1.7g.
分析 (1)根据题目信息,实验室通过上述某种过氧化物与适量稀硫酸作用,过滤后即可制得较纯净的H2O2溶液,说明生成了沉淀;
(2)过氧化氢与次氯酸钠的反应中因为ClO-中的氯元素的化合价为+1价,次氯酸根具有氧化性,则H2O2具有还原性;根据化合价变化确定电子的转移电子;
(2)酸性高锰酸钾溶液与H2O2反应,H2O2是还原剂被氧化,-2价氧元素的化合价全部升高,根据电子守恒配平方程式并进行相应计算.
解答 解:(1)实验室通过上述某种过氧化物与适量稀硫酸作用,过滤后即可制得较纯净的H2O2溶液,说明生成了硫酸钡沉淀,所以选用BaO2,
故答案为:BaO2;
(2)过氧化氢与次氯酸钠的反应中因为ClO-中的氯元素的化合价为+1价,次氯酸根具有氧化性,则H2O2具有还原性,反应的方程式为:H2O2+NaClO═H2O+NaCl+O2,生成一个氧气失去2个电子,所以生成0.5mol氧气,转移电子1mol,
故答案为:H2O2;H2O2+NaClO=H2O+NaCl+O2↑; 1;
(3)酸性高锰酸钾溶液与H2O2反应,H2O2是还原剂被氧化,-2价氧元素的化合价全部升高;而②中-2价氧元素的化合价没有全部发生变化,根据电子守恒,配平后的化学反应方程式为:5H2O2+2KMnO4+3H2SO4→2MnSO4+K2SO4+5O2↑+8H2O,滴定终点,溶液由无色变成紫红色,且在半分钟内溶液颜色不褪去,5H2O2~2KMnO4,消耗0.50mol/L的高锰酸钾溶液40.00ml,则双氧水的物质的量是:=0.05mol,质量是0.05mol×34g/mol=1.7g,
故答案为:溶液由无色变成紫红色,且在半分钟内溶液颜色不褪去;1.7g.
点评 本题主要考查了过氧化氢的制备与性质,需要注意的是H2O2具有氧化性、还原性,遇到氧化剂时作还原剂,氧化产物为氧气;遇到还原时作氧化剂,还原产物为水.

| A. | 沸点高低:HI>HBr>HCl>HF | |
| B. | 热稳定性大小:HF>H2O>NH3>PH3 | |
| C. | 熔点高低:金刚石>食盐>金属钠>冰 | |
| D. | 微粒半径大小:S2->Cl->F->Na+>Al3+ |
| A. | 丙烷最多6个原子处于同一平面 | |
| B. | 环己烷最多有12个原子处于同一平面上 | |
| C. | 苯乙烯最多有16个原子处于同一平面上 | |
| D. | CH3CH=CH-C≡C-CF3最多有10个原子处于同一平面上 |
| A. | 有机物不一定都不溶于水 | |
| B. | 有机物都是共价化合物 | |
| C. | 有机物都是从有机体中分离出来的物质 | |
| D. | 有机物不具备无机物的性质 |
| A. | 鱼虾会产生不愉快的腥臭味,可在烹调时加入少量食醋和料酒 | |
| B. | “酸可以除锈”,“汽油可以去油污”都是发生了化学变化 | |
| C. | 被蜂蚁蜇咬会感觉疼痛难忍,这是由于人的皮肤被注入了甲酸的缘故,此时若能涂抹稀氨水或碳酸氢钠溶液,可以减轻疼痛 | |
| D. | 苯酚溶液可用于环境消毒,医用酒精可用于皮肤消毒 |
(1)N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下:
| 电离能 | I1 | I2 | I3 | I4 | … |
| Ia/kJ•mol-1 | 578 | 1 817 | 2 745 | 11 578 | … |
(2)基态锗(Ge)原子的价层电子排布式是4s24p2.Ge的最高价溴化物分子式是GeBr4.该元素可能的性质或应用有BD.
A.是一种活泼的金属元素 B.其单质可作为半导体材料
C.其元素的电负性大于硫元素 D.其最高价氯化物的沸点低于其溴化物的沸点
(3)关于化合物
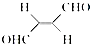 ,下列叙述正确的有AD.
,下列叙述正确的有AD.A.该分子在水中的溶解度大于2-丁烯
B.分子中只有极性键
C.分子中有7个σ键和1个π键
D.该化合物既能发生还原反应又能发生氧化反应
E.分子间可形成氢键
(4)NaF的熔点>
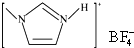 的熔点(填“>”、“=”或“<”),其原因是
的熔点(填“>”、“=”或“<”),其原因是两者均为离子化合物,且阴阳离子电荷数均为1,但后者的离子半径较大,离子键较弱,因此其熔点较低.
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一.1molNH4BF4含有2mol配位键.
 碳是地球上含量丰富的元素,其氧化物的研究有着重要意义.
碳是地球上含量丰富的元素,其氧化物的研究有着重要意义.