题目内容
将35.8g Al、Fe、Cu组成的合金溶于足量的NaOH溶液中,产生6.72L气体(标准状况下)。另取等质量的该合金溶于过量的稀硝酸中,生成13.44L NO(标准状况下),向反应后的溶液中加入足量的NaOH溶液,得到沉淀的质量为
| A.66.4 g | B.50.8 g | C.44.8g | D.39.2g |
B
解析试题分析:金属投入碱中铝与碱反应,n(Al)=2/3n(H2)=2/3×6.72÷22.4=0.2mol,m(Al)=27×0.2=5.4g金属与硝酸反应全部溶解,与碱反应生成氢氧化铁和氢氧化铜沉淀(氢氧化铝溶解于强碱),根据反应中金属失去带负电荷的电子,最后结合带负电荷的氢氧根离子,根据电荷守恒得出金属失去电子的物质的量等于金属离子结合氢氧根离子的量,最终得到沉淀的量为金属的量(去掉铝)与氢氧根离子的量和,n(OH-)=n(e-)=13.44÷22.4×3(NO得到电子的量)-0.2×3(铝失去电子量)=1.2mol沉淀质量为35.8-5.4+1.2×17=50.8g
考点:考查化学计算有关问题。

火法炼铜首先要焙烧黄铜矿,其反应为:2CuFeS2+O2→Cu2S+2FeS+SO2 下列说法正确的是
| A.Cu2S既是氧化产物又是还原产物 |
| B.每生成1 molCu2S,有4mol硫被氧化 |
| C.CuFeS2仅作还原剂,硫元素被氧化 |
| D.每转移1.2 mol电子,有0.2 mol硫被氧化 |
化学工业是国民经济的支柱产业,下列生产过程中不涉及氧化还原反应的是
| A.纯碱厂用侯氏制碱法制纯碱 | B.硝酸厂用氨氧化法制硝酸 |
| C.硫酸厂用接触法生产硫酸 | D.氮肥厂用氮气和氢气合成氨气 |
在AlCl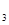 和FeCl
和FeCl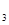 混合溶液中,先加入过量的KI溶液,再加入足量的Na
混合溶液中,先加入过量的KI溶液,再加入足量的Na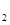 S溶液,所得 到的沉淀物是
S溶液,所得 到的沉淀物是
A.Fe(OH)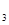 、Al(OH) 、Al(OH)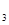 | B.Al(OH)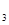 、I 、I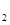 |
C.Fe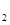 S S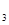 、I 、I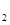 | D.FeS、S、Al(OH)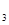 |
一定体积的KMnO4溶液恰好能氧化一定质量的KHC2O4·H2C2O4·2H2O。若用0.1000mol/L的NaOH溶液中和相同质量的KHC2O4·H2C2O4·2H2O,所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol/L)为( )
提示:①H2C2O4是二元弱酸
②10[KHC2O4·H2C2O4]+8KMnO4+17H2SO4=8MnSO4+9K2SO4+40CO2↑+32H2O
| A.0.008889 | B.0.08000 | C.0.1200 | D.0.2400 |
氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与Br2+SO2+2H2O=H2SO4+2HBr相比较,水的作用不相同的是( )
| A.2Al+2NaOH+2H2O=2NaAlO2+3H2↑ |
| B.4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
| C.BrCl+H2O=HCl+HbrO |
| D.2Na2O2+2H2O=4NaOH+O2↑ |
氰氨基化钙是一种重要的化工原料,其制备的化学方程式为:CaCO3+2HCN = CaCN2+CO↑+H2↑+CO2↑,下列说法正确的是
| A.CO为氧化产物,H2为还原产物 |
| B.CaCN2中含有非极性键 |
| C.HCN既是氧化剂又是还原剂 |
| D.每消耗10g CaCO3生成2.24L CO2 |
锑(Sb)在自然界一般以硫化物的形式存在,我国锑的蕴藏量为世界第一,从硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原:
①2Sb2S3+3O2+6Fe Sb4O6+6FeS②Sb4O6+6C
Sb4O6+6FeS②Sb4O6+6C 4Sb+6CO↑,关于反应①、②的说法正确的是( )
4Sb+6CO↑,关于反应①、②的说法正确的是( )
A.反应①②中的氧化剂分别是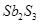 、 、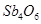 |
| B.反应①中每生成1mol FeS时,共转移3mol电子 |
| C.反应②说明高温下C的还原性比Sb强 |
| D.每生成4mol Sb时,反应①与反应②中还原剂的物质的量之比为4:3 |
天宫一号搭载的长征二号火箭使用的主要燃料是偏二甲肼(用R表示)和四氧化二氮,在火箭发射时,两者剧烈反应产生大量气体并释放出大量的热,该反应的化学方程式为:R + 2N2O4= 3N2 + 4H2O + 2CO2,下列叙述错误的是
| A.此反应可在瞬间产生大量高温气体,推动火箭飞行 |
| B.此反应是氧化还原反应,N2O4做还原剂 |
| C.此反应是氧化还原反应,偏二甲肼做还原剂 |
| D.此反应中R的分子式为C2H8N2 |