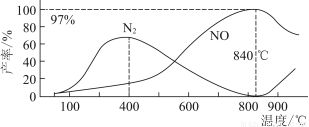
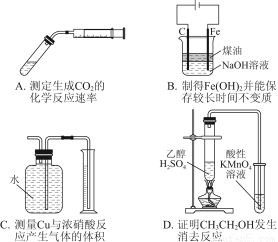
题目内容
R、X、Y、M、Z 5种短周期主族元素的原子半径依次减小,X、Y、Z的电子层数之和为5,X元素原子的最外层电子数是它的电子层数的2倍,Y元素原子的最外层电子数是X和Z两元素原子最外层电子数的总和,M是地壳中含量最多的元素,R与Z的最外层电子数相同。下列叙述正确的是( )
A.Z与M形成的化合物中不可能含有非极性键
B.对应氢化物的热稳定性:X > Y >M
C.单质的还原性:R> M>Y>X
D.X、Y、M、Z 4种元素组成的离子化合物受热易分解
D
【解析】由“X元素原子的最外层电子数是它的电子层数的2倍”,则X为碳元素或硫元素,再结合X、Y、Z电子层数之和为5,则X为碳元素。从而可推出Y、M、Z分别为氮、氧、氢元素,而R则可能为锂元素或钠元素。氢元素与氧元素形成的化合物H2O2中含有的氧氧键为非极性键,A项错误;非金属性:O>N>C,对应氢化物的稳定性:H2O>NH3>CH4,B项错误;O2几乎没有还原性,C项错误;C、N、O、H元素组成的离子化合物为NH4HCO3或(NH4)2CO3,受热易分解,D项正确

练习册系列答案
 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案
相关题目
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | c(HA)/mol·L-1 | c(NaOH)/mol·L-1 | 混合后溶液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | b | 0.2 | pH=7 |
丙 | 0.2 | 0.1 | pH<7 |
丁 | 0.1 | 0.1 | pH=c |
下列对混合后溶液的有关说法中,不正确的是( )
A.甲中:若a=7,则HA是强酸
B.乙中:若b≠0.2,则c(A-)≠c(Na+)
C.丙中:若HA是弱酸,则c(A-)>c(Na+)>c(H+)>c(OH-)
D.丁中:若c=9,则c(OH-)-c(HA)=10-9 mol·L-1