题目内容
16.取6根铁钉,6支干净的试管及其他材料,如图所示.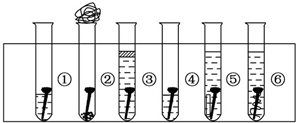
试管①放入一根铁钉,再注入蒸馏水,使铁钉和空气及水接触;
试管②在试管底部放入硅胶(是一种干燥剂),再放入铁钉,用棉花团堵住试管口,使铁钉和干燥空气接触;
试管③先放入一根铁钉,趁热倒入煮沸的蒸馏水(已赶出原先溶解在蒸馏水中的空气)浸没铁钉,再加上一层植物油,使铁钉不能跟空气接触;
试管④中放入铁钉注入食盐水,使铁钉和空气及食盐水接触;
试管⑤放入相连的铁钉和锌片,注入自来水,浸没铁钉和锌片;
试管⑥放入相连的铁钉和铜丝,注入自来水,浸没铁钉和铜丝.
把6支试管放在试管架上,几天后观察铁钉被腐蚀的情况.
(1)上述实验中铁钉发生了电化学腐蚀的是①④⑥ (填试管序号);在电化学腐蚀中,负极反应是Fe-2e-═Fe2+,正极反应是O2+2H2O+4e-═4OH-.
(2)从铁钉被腐蚀的情况可知引起和促进铁钉被腐蚀的条件是水、空气、电解质溶液和不活泼金属杂质的存在.
(3)为防止铁的锈蚀,工业上普遍采用的方法是在表面涂上油漆、搪瓷、沥青等或镀上不易生锈的合金或牺牲阳极保护法(答出其中两种即可)(答两种方法).
分析 (1)金属的电化学腐蚀是因为形成原电池装置的腐蚀,金属是负极,发生氧化反应,正极上氧气发生得电子的还原反应;
(2)金属生锈的条件:金属和空气中的氧气、水(电解质)以及不活泼金属杂质存在,构成原电池装置;
(3)金属和的防护方法:让金属隔绝空气,或是让金属做原电池的正极或是电解池的阴极.
解答 解:(1)金属的电化学腐蚀是因为形成原电池装置的腐蚀,述实验中铁钉发生了电化学腐蚀的是①④⑥,金属铁是负极,发生氧化反应,Fe-2e-═Fe2+,正极上氧气发生得电子的还原反应O2+2H2O+4e-═4OH-,
故答案为:①④⑥;Fe-2e-═Fe2+;O2+2H2O+4e-═4OH-;
(2)金属和空气中的氧气、水(电解质)以及不活泼金属杂质存在,构成原电池装置,这些是引起和促进铁钉被腐蚀的条件,故答案为:水、空气、电解质溶液和不活泼金属杂质的存在;
(3)为防止铁的锈蚀,可以在表面涂上油漆、搪瓷、沥青等或镀上不易生锈的合金或牺牲阳极保护法,故答案为:在表面涂上油漆、搪瓷、沥青等或镀上不易生锈的合金或牺牲阳极保护法(答出其中两种即可).
点评 本题主要考查了金属生锈的条件和金属的防护方面的知识,注意知识的迁移应用和归纳总结是关键,难度中等.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
6.下列价电子排布式表示的四种元素中,电负性最大的是( )
| A. | 4s1 | B. | 2s22p5 | C. | 3s23p4 | D. | 3d64s2 |
11.一定量某营养液中溶质的配方分别如下:
配方一:0.3mol KCl、0.2mol K2SO4、0.1molZnSO4
配方二:0.1mol KCl、a mol K2SO4、0.1molZnCl2
对于两种营养液的成分,下列说法中不正确的是( )
配方一:0.3mol KCl、0.2mol K2SO4、0.1molZnSO4
配方二:0.1mol KCl、a mol K2SO4、0.1molZnCl2
对于两种营养液的成分,下列说法中不正确的是( )
| A. | 两配方中n(Cl-)相同 | |
| B. | 两配方中n(Zn2+)和a的取值无关 | |
| C. | 当a=0.3时两配方中各种离子的物质的量分别相同 | |
| D. | 当a=0.2时两配方中n(Cl-)、n(Zn2+)和n(SO42-)分别相同 |
1.下列说法正确的是( )
| A. | 形成离子键的阴阳离子只存在静电吸引力 | |
| B. | 元素周期律是元素的原子核外电子排布周期性变化的结果 | |
| C. | 第三周期非金属元素含氧酸的酸性从左到右依次增加 | |
| D. | 离子化合物中只能含离子键、极性共价键 |
8.有关化学用语正确的是( )
| A. | 质子数27的钴-60原子:60 27Co | |
| B. | 氯化铵的电子式: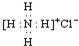 | |
| C. | S2-的结构示意图: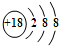 | |
| D. | Cl-的电子排布式:1s22s22p63s23p5 |
5.反应物和生成物均为气态的平衡体系,平衡常数表达式为:K=$\frac{c(x)•{c}^{2}(y)}{{c}^{3}(z)•{c}^{2}(w)}$,有关该平衡体系说法不正确的是( )
| A. | 升高温度,该反应平衡常数K的变化无法判断 | |
| B. | 增大压强,W的质量分数减小 | |
| C. | 该反应的化学方程式为:3z(g)+2w(g)?x(g)+2y(g) | |
| D. | 增大X气体浓度平衡向正反应方向移动 |
6.下列说法正确的是( )
| A. | 摩尔是用来衡量微观粒子多少的一种物理量 | |
| B. | 在一定的温度和压强下,各种气体的摩尔体积相等 | |
| C. | 阿伏加德罗常数的数值是0.012kg14C所含的原子个数 | |
| D. | 若气体摩尔体积为22.4L•mol-1,则所处条件为标准状况 |
