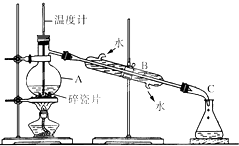
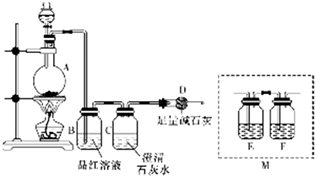
题目内容
7.为了除去氯化钠样品中的杂质碳酸钠,某兴趣小组最初设计了如下所示方案进行实验.
(1)沉淀A的化学式是CaCO3.
(2)加入过量氯化钙溶液后,分离除去沉淀A的实验操作过程是将混合物沿玻璃棒加入到过滤器中,待液体滤出,收集滤液,即已除去了沉淀A.
(3)他们在实验过程中,又发现了新的问题:此方案很容易引入新的杂质.固体物质B的成分为NaCl、CaCl2(用化学式表示).
(4)他们继续探究后又提出了新的方案:将混合物溶解,滴加盐酸至不再产生气泡为止,然后加热煮沸.有关反应的化学方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑.
分析 除去氯化钠样品中的杂质碳酸钠,由实验流程可知,溶于水后,加过量氯化钙发生Na2CO3+CaCl2=CaCO3↓+2NaCl,则沉淀A为CaCO3,然后过滤分离出沉淀,对滤液蒸发得到NaCl,因氯化钙过量,则B中含NaCl、CaCl2;
若将混合物溶解,滴加盐酸至不再产生气体为止,既能除去碳酸钠杂质,又能有效地防止新杂质的引入,因碳酸钠与盐酸反应生成氯化钠、水、二氧化碳.
解答 解:除去氯化钠样品中的杂质碳酸钠,由实验流程可知,溶于水后,加过量氯化钙发生Na2CO3+CaCl2=CaCO3↓+2NaCl,则沉淀A为CaCO3,然后过滤分离出沉淀,对滤液蒸发得到NaCl,因氯化钙过量,则B中含NaCl、CaCl2;
(1)由上述分析可知,沉淀A为CaCO3,故答案为:CaCO3;
(2)分离除去沉淀A的实验操作方法是将混合物沿玻璃棒加入到过滤器中,待液体滤出,收集滤液即已除去了沉淀A,
故答案为:将混合物沿玻璃棒加入到过滤器中,待液体滤出,收集滤液即已除去了沉淀A;
(3)因氯化钙过量,则B中含NaCl、CaCl2,故答案为:NaCl、CaCl2;
(4)若将混合物溶解,滴加盐酸至不再产生气体为止,既能除去碳酸钠杂质,又能有效地防止新杂质的引入,因碳酸钠与盐酸反应生成氯化钠、水、二氧化碳,发生的化学反应为Na2CO3+2HCl═2NaCl+H2O+CO2↑,故答案为:Na2CO3+2HCl═2NaCl+H2O+CO2↑.
点评 本题考查混合物分离提纯的综合应用,为高频考点,把握流程中的反应、混合物分离提纯方法解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的综合应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下列化学用语表达错误的是( )
| A. | NH3的电子式: | |
| B. | 氯离子的结构示意图: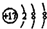 | |
| C. | CS2的结构式:S=C=S | |
| D. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O |
15.下列反应的离子方程式正确的是( )
| A. | 向沸水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O═Fe(OH)3↓+3H+ | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 向含有0.4 mol FeBr2溶液中通入0.3 mol Cl2充分反应:4Fe2++2Br-+3Cl2═4Fe+3+6Cl-+Br2 | |
| D. | 用Pt电极电解饱和氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ |
2.下列说法中正确的是( )
| A. | 不能发生丁达尔效应的分散系有氯化钠溶液、水等 | |
| B. | 根据分散系的稳定性,将分散系分为胶体、浊液和溶液 | |
| C. | 可吸入颗粒(如硅酸盐粉尘)能形成气溶胶,对人类的健康危害极大 | |
| D. | FeCl3溶液与Fe(OH)3胶体的本质区别是有无丁达尔效应 |
12.下列物质分类正确的一组是( )
| 选项 | A | B | C | D |
| 电解质 | 浓硫酸 | 胆矾 | 硫酸钡 | 冰醋酸 |
| 混合物 | 漂白粉 | 蛋白质 | 水玻璃 | 冰水混合物 |
| 酸性氧化物 | SO2 | Mn2O7 | SiO2 | NO2 |
| 酸 | HClO4 | H2SiO3 | NaHSO4 | CH3COOH |
| A. | A | B. | B | C. | C | D. | D |
17.把O2、NO、NO2以1:1:2体积比混合充满大试管,倒立于水中充分吸收,结果是( )
| A. | 液面上升,剩余NO | B. | 液面上升剩余O2 | C. | 液面上升剩余NO2 | D. | 溶液充满试管 |