题目内容
13.甲、乙两杯醋酸稀溶液,甲的pH=a,乙的pH=a+1,对下列叙述的判断正确的是( )①甲由水电离出来的H+的物质的量浓度是乙的$\frac{1}{10}$倍
②物质的量浓度c(甲)=10c(乙)
③中和等物质的量的NaOH溶液需甲、乙两杯酸的体积,10V(甲)>V(乙)
④甲中的c(OH-)为乙中的c(OH-)的10倍.
| A. | ①②④正确 | B. | ①③正确 | C. | ②④正确 | D. | 只有①正确 |
分析 ①酸溶液中水电离出的c(H+)等于溶液中c(OH-);
②溶液越稀,醋酸的电离程度越大,据此判断酸的浓度大小;
③酸的浓度越大,消耗酸的体积越小;
④根据c(OH-)=$\frac{{K}_{W}}{c({H}^{+})}$分析.
解答 解:①c(H+)=10-pH,所以c (H+)甲=10-a,c (H+)乙=10-(a+1),所以c(H+)甲=10c (H+)乙,酸溶液中水电离出的c(H+)等于溶液中c(OH-),所以c(OH-)=$\frac{{K}_{W}}{c({H}^{+})}$,所以氢氧根离子浓度:10c (OH-)甲=c (OH-)乙,则水电离出的氢离子浓度10c(H+)甲=c(H+)乙,故①正确;
②酸的浓度越大,酸的电离程度越小,c(甲)>10c(乙),故②错误;
③酸的浓度越大,酸的电离程度越小,与等量NaOH反应,酸的浓度越大则消耗酸的体积越小,c(甲)>10c(乙),所以消耗酸的体积,10V(甲)<V(乙),故③错误;
④c(OH-)=$\frac{{K}_{W}}{c({H}^{+})}$,所以氢氧根离子浓度:10c (OH-)甲=c (OH-)乙,故④错误;
故选D.
点评 本题考查弱电解质的电离,注意弱电解质的电离程度和浓度的关系,为易错点,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.下列离子方程式正确的是( )
| A. | 用惰性电极电解饱和氯化钠溶液:2Cl-+2H+ $\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑ | |
| B. | 用银氨溶液检验乙醛中的醛基: CH3CHO+2Ag(NH3)2++2OH-$\stackrel{水浴加热}{→}$CH3COONH4+3NH3+2Ag↓+H2O | |
| C. | Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-═5SO42-+2Mn2+ 3H2O | |
| D. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+2CO32- |
1.下列反应属于加成反应的是( )
| A. | 甲烷与氯气反应 | B. | 乙烷的燃烧 | ||
| C. | 乙烯使酸性高锰酸钾溶液褪色 | D. | 乙烯使溴水褪色 |
8.“化学无处不在”,下列与化学有关的说法不正确的是( )
| A. | 纤维素在人体内可水解为葡萄糖,故可作人类的营养物质 | |
| B. | 鱼虾会产生不愉快的腥臭味,可在烹调时加入少量食醋和料酒 | |
| C. | 被蜂蚁蜇咬会感觉疼痛难忍,这是由于人的皮肤被注入了甲酸的缘故,此时若能涂抹稀氨水或碳酸氢钠溶液,可以减轻疼痛 | |
| D. | 苯酚溶液可用于环境消毒,医用酒精可用于皮肤消毒,其原因均在于可使蛋白质变性凝固 |
2.下列离子方程式正确的是( )
| A. | Fe(OH)2溶于稀硝酸中 Fe(OH)2+3H+=Fe2++3H2O | |
| B. | H218O中投入Na2O2固体 2H218O+2O22-=4OH-+18O2↑ | |
| C. | 铝片跟氢氧化钠溶液反应:Al+2OH-=AlO2-+H2↑ | |
| D. | 等体积等物质的量浓度的Ba(OH)2溶液与明矾溶液混合3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓ |
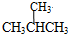 和
和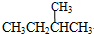 ;⑦
;⑦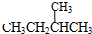 和
和
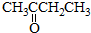
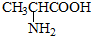 与
与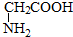
 与
与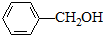
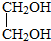 与
与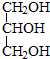
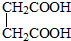 与
与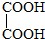
 ,并指出其中共平面的碳原子数目最多是4.
,并指出其中共平面的碳原子数目最多是4.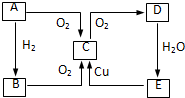 在图中A、B、C、D、E中均含有硫元素,通常状况下,A为固体单质,根据右图的转化关系,回答:
在图中A、B、C、D、E中均含有硫元素,通常状况下,A为固体单质,根据右图的转化关系,回答: ,共价键
,共价键