题目内容
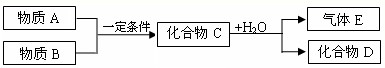
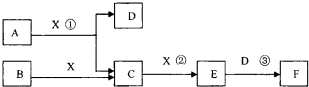
短周期常见元素形成的纯净物A、B、C、D、E转化关系如图所示,物质A与物质B之间的反应不在溶液中进行(E可能与A、B两种物质中的某种相同).
请回答下列问题:
Ⅰ.若A为金属,C是离子化合物,D是一种常见的强碱.
(1)写出A的离子结构示意图______.C的化学式______.
(2)D与等物质的量醋酸反应所得溶液的PH______7,(填“>”,“<”,“=”).原因是(用文字和离子方程式说明)
______.
Ⅱ.若C是一种气体,D是一种强酸,则:
(3)C与水反应的化学方程式为______.
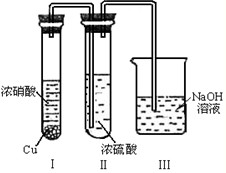
(5)有人认为“浓H2SO4可以干燥气体C”.某同学为了验证该观点是否正确,用如图装置进行实验.实验过程中,浓H2SO4中未发现有气体逸出,且变为红棕色,则你得出的解释和结论是______.

请回答下列问题:
Ⅰ.若A为金属,C是离子化合物,D是一种常见的强碱.
(1)写出A的离子结构示意图______.C的化学式______.
(2)D与等物质的量醋酸反应所得溶液的PH______7,(填“>”,“<”,“=”).原因是(用文字和离子方程式说明)
______.
Ⅱ.若C是一种气体,D是一种强酸,则:
(3)C与水反应的化学方程式为______.
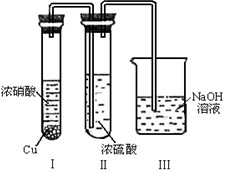
(5)有人认为“浓H2SO4可以干燥气体C”.某同学为了验证该观点是否正确,用如图装置进行实验.实验过程中,浓H2SO4中未发现有气体逸出,且变为红棕色,则你得出的解释和结论是______.

Ⅰ.短周期元素形成的强碱有NaOH,则D为NaOH,C为Na2O2,E为O2,A为金属,应为Na,B也为O2,则
(1)A为Na,对应Na+的质子数为11,核外有10个电子,离子的结构示意图为
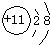
,C为Na2O2,
故答案为:
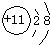
; Na2O2;
(2)NaOH和醋酸反应生成CH3COONa,为强碱弱酸盐,在溶液中发生CH3COO-+H2O

CH3COOH+OH-,溶液呈碱性,pH>7,
故答案为:>;生成的醋酸钠是强碱弱酸盐,水解呈碱性.离子方程式为CH3COO-+H2O

CH3COOH+OH-;
Ⅱ.若C是一种气体,D是一种强酸,则C和水的反应应为NO2和水反应,生成物D为HNO3,E为NO,C为NO2,
(3)C为NO2,与水反应的化学方程式为3NO2+H2O═2HNO3+NO,
故答案为:3NO2+H2O═2HNO3+NO;
(4)浓H2SO4中未发现有气体逸出,且变为红棕色,说明NO2能溶于浓硫酸中,溶液呈红棕色是因为溶解NO2的原因,则浓硫酸不能干燥NO2,
故答案为:NO2能溶于浓硫酸中,浓硫酸不能干燥NO2.
(1)A为Na,对应Na+的质子数为11,核外有10个电子,离子的结构示意图为
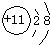
,C为Na2O2,
故答案为:
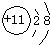
; Na2O2;
(2)NaOH和醋酸反应生成CH3COONa,为强碱弱酸盐,在溶液中发生CH3COO-+H2O

CH3COOH+OH-,溶液呈碱性,pH>7,
故答案为:>;生成的醋酸钠是强碱弱酸盐,水解呈碱性.离子方程式为CH3COO-+H2O

CH3COOH+OH-;
Ⅱ.若C是一种气体,D是一种强酸,则C和水的反应应为NO2和水反应,生成物D为HNO3,E为NO,C为NO2,
(3)C为NO2,与水反应的化学方程式为3NO2+H2O═2HNO3+NO,
故答案为:3NO2+H2O═2HNO3+NO;
(4)浓H2SO4中未发现有气体逸出,且变为红棕色,说明NO2能溶于浓硫酸中,溶液呈红棕色是因为溶解NO2的原因,则浓硫酸不能干燥NO2,
故答案为:NO2能溶于浓硫酸中,浓硫酸不能干燥NO2.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目






 CH3COOH+OH-
CH3COOH+OH-