题目内容
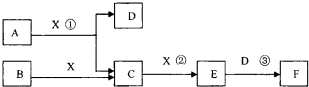
短周期常见元素形成的纯净物A、B、C、D、E转化关系如图1所示,物质A与物质B之司的反应不在溶液中进行(E可能与A、B两种物质中某种相同)

请同答下列问题:
(1)若C是离子化合物,D是一种强碱,写出C的化学式
(2)若C与水发生复分解反应,E的水溶液呈现弱酸性,D是既能溶于强酸、又有溶于强碱的化合物,写出实验室制取D的离子方程式为
(3)若C是有色气体,D是一种强酸,则:
①C与水反应的化学方程式为
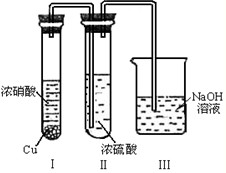
②有人认为“浓H2SO4可以干燥气体C”.某同学为了验证该观点是否正确,用图2装置进行实验.实验过程中,浓H2SO4变为红棕色,且Ⅱ装置末发现有气体逸出,则你得出的结论是

请同答下列问题:
(1)若C是离子化合物,D是一种强碱,写出C的化学式
Na2O2(或NaH)
Na2O2(或NaH)
.(2)若C与水发生复分解反应,E的水溶液呈现弱酸性,D是既能溶于强酸、又有溶于强碱的化合物,写出实验室制取D的离子方程式为
Al3++3NH3?H2O═Al(OH)3↓+3NH4+
Al3++3NH3?H2O═Al(OH)3↓+3NH4+
.(3)若C是有色气体,D是一种强酸,则:
①C与水反应的化学方程式为
3NO2+H2O═2HNO3+NO
3NO2+H2O═2HNO3+NO
.②有人认为“浓H2SO4可以干燥气体C”.某同学为了验证该观点是否正确,用图2装置进行实验.实验过程中,浓H2SO4变为红棕色,且Ⅱ装置末发现有气体逸出,则你得出的结论是
NO2能溶于浓硫酸中,浓硫酸不能干燥NO2
NO2能溶于浓硫酸中,浓硫酸不能干燥NO2
.分析:(1)若C是离子化合物,D是一种强碱,可能为NaOH,则C可为Na2O2(或NaH),生成气体为O2或H2;
(2)D是既能溶于强酸、又有溶于强碱的化合物,应为Al(OH)3,E的水溶液呈现弱酸性,应为CO2;
(3)C是有色气体,应为NO2,则D为HNO3,E为NO,结合物质的性质解答该题.
(2)D是既能溶于强酸、又有溶于强碱的化合物,应为Al(OH)3,E的水溶液呈现弱酸性,应为CO2;
(3)C是有色气体,应为NO2,则D为HNO3,E为NO,结合物质的性质解答该题.
解答:解:(1)若C是离子化合物,D是一种强碱,可能为NaOH,则C可为Na2O2(或NaH),生成气体为O2或H2,
故答案为:Na2O2(或NaH);
(2)D是既能溶于强酸、又有溶于强碱的化合物,应为Al(OH)3,E的水溶液呈现弱酸性,应为CO2,实验室制备Al(OH)3,由硫酸铝和氨水反应,
离子方程式为Al3++3NH3?H2O═Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3?H2O═Al(OH)3↓+3NH4+;
(3)C是有色气体,应为NO2,则D为HNO3,E为NO,
①NO2与水反应的方程式为3NO2+H2O═2HNO3+NO,
故答案为:3NO2+H2O═2HNO3+NO;
②由现象实验过程中,浓H2SO4中未发现有气体逸出,且浓H2SO4由无色变为红棕色,可以得出NO2能溶于浓硫酸中,
故答案为:NO2能溶于浓硫酸中,浓硫酸不能干燥NO2.
故答案为:Na2O2(或NaH);
(2)D是既能溶于强酸、又有溶于强碱的化合物,应为Al(OH)3,E的水溶液呈现弱酸性,应为CO2,实验室制备Al(OH)3,由硫酸铝和氨水反应,
离子方程式为Al3++3NH3?H2O═Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3?H2O═Al(OH)3↓+3NH4+;
(3)C是有色气体,应为NO2,则D为HNO3,E为NO,
①NO2与水反应的方程式为3NO2+H2O═2HNO3+NO,
故答案为:3NO2+H2O═2HNO3+NO;
②由现象实验过程中,浓H2SO4中未发现有气体逸出,且浓H2SO4由无色变为红棕色,可以得出NO2能溶于浓硫酸中,
故答案为:NO2能溶于浓硫酸中,浓硫酸不能干燥NO2.
点评:本题考查无机物的推断,以物质的性质为载体综合考查物质的性质探究,侧重于学生的分析能力和探究能力的考查,题目难度中等,明确物质的种类为解答该题的关键.

练习册系列答案
相关题目






 CH3COOH+OH-
CH3COOH+OH-