题目内容
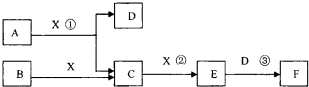
(2013?红桥区二模)已知由短周期常见元素形成的纯净物A、B、C、D、E、F、X转化关系如下图所示,B、X为单质,D常温下为无色液体,E是大气污染物且为红棕色气体,F是一元强酸,反应①是工业制备F的第一步反应.A、B含同一种元素.(某些产物可能略去)
请回答下列问题:
(l)B的电子式为
 .写出A与X反应的化学方程式
.写出A与X反应的化学方程式
(2)下列关于比较B和X所含元素的非金属性强弱的研究方案不可行的是
①比较两种气态氢化物的沸点
②比较两种气态氢化物的稳定性
③比较最高价氧化物对应的水化物的酸性
④比较最高价氧化物对应的水化物的氧化性
(3)已知常温下1mol气体E发生反应③放出46kJ热量,写出气体E与D反应的热化学反应方程式
(4)在常温下,向V1L pH=a的A溶液中加入V2L pH=b的盐酸,且a+b=14,若反应后溶液的pH<7,则v1和v2的关系为V1

请回答下列问题:
(l)B的电子式为


4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
.
| ||
| △ |
(2)下列关于比较B和X所含元素的非金属性强弱的研究方案不可行的是
①③④
①③④
(填序号)①比较两种气态氢化物的沸点
②比较两种气态氢化物的稳定性
③比较最高价氧化物对应的水化物的酸性
④比较最高价氧化物对应的水化物的氧化性
(3)已知常温下1mol气体E发生反应③放出46kJ热量,写出气体E与D反应的热化学反应方程式
3NO2(g)+H2O(l)=2HNO3(aq)+NO(g);△H=-138kJ/mol
3NO2(g)+H2O(l)=2HNO3(aq)+NO(g);△H=-138kJ/mol
(4)在常温下,向V1L pH=a的A溶液中加入V2L pH=b的盐酸,且a+b=14,若反应后溶液的pH<7,则v1和v2的关系为V1
<
<
V2(选填“>”、“<”或“无法确定”),所得溶液中各种离子的浓度由大到小的顺序可能是c(Cl-)>c(NH4+)>c(H+)>c(OH-)或c(Cl-)>c(H+)>c(NH4+)>c(OH-)
c(Cl-)>c(NH4+)>c(H+)>c(OH-)或c(Cl-)>c(H+)>c(NH4+)>c(OH-)
(写出一种情况即可).分析:D常温下为无色液体为水,E是大气污染物且为红棕色气体,所以E是二氧化氮,X是单质,C和X反应生成二氧化氮,且X是单质,所以X是氧气,C是一氧化氮,二氧化氮和水反应生成硝酸和一氧化氮,F是一元强酸,所以F是硝酸,B是单质,和氧气反应生成一氧化氮,则B是氮气,A和氧气反应生成一氧化氮和水,A、B含同一种元素,根据元素守恒知,A是氨气.
解答:解:D常温下为无色液体为水,E是大气污染物且为红棕色气体,所以E是二氧化氮,X是单质,C和X反应生成二氧化氮,且X是单质,所以X是氧气,C是一氧化氮,二氧化氮和水反应生成硝酸和一氧化氮,F是一元强酸,所以F是硝酸,B是单质,和氧气反应生成一氧化氮,则B是氮气,A和氧气反应生成一氧化氮和水,A、B含同一种元素,根据元素守恒知,A是氨气.
(1)氮气的电子式为: ,在加热、催化剂条件下,氨气和氧气发生氧化还原反应生成水和一氧化氮,反应方程式为:4NH3+5O2
,在加热、催化剂条件下,氨气和氧气发生氧化还原反应生成水和一氧化氮,反应方程式为:4NH3+5O2
4NO+6H2O,
故答案为: ;4NH3+5O2
;4NH3+5O2
4NO+6H2O,
(2)比较两种元素的非金属性强弱,可根据单质之间的置换反应、与氢气反应的难易程度、氢化物的稳定性以及最高正价氧化物对应水化物酸性强弱,注意氧元素自身不能形成氧化物,
①不能根据两种气态氢化物的沸点确定非金属性强弱,故错误;
②比较两种气态氢化物的稳定性能确定非金属性强弱,故正确;
③氧元素自身不能形成氧化物,故错误;
④氧元素自身不能形成氧化物,故错误;
故选①③④;
(3)1mol气体二氧化氮发生反应③放出46kJ热量,则3mol二氧化氮和水反应放出138kJ热量,所以二氧化氮与水反应的热化学反应方程式为3NO2(g)+H2O(l)=2HNO3(aq)+NO(g);△H=-138kJ/mol,
故答案为:3NO2(g)+H2O(l)=2HNO3(aq)+NO(g);△H=-138kJ/mol;
(4)在常温下,向V1L pH=a的氨水溶液中c(OH-)=10 a-14 mol/L,
V2L pH=b的盐酸溶液中c(H+)=10-b mol/L,且a+b=14,所以c(OH-)=c(H+)=10-b mol/L=10 a-14 mol/L<c(NH3.H2O),
若反应后溶液的pH<7,则盐酸应过量,所以v1和v2的关系为V1<V2,
溶液呈酸性,则c(OH-)<c(H+),如果溶液中的溶质氯化铵多,则离子大小顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-),如果溶液中的溶质盐酸多,则离子浓度大小顺序是c(Cl-)>c(H+)>c(NH4+)>c(OH-),故答案为:c(Cl-)>c(NH4+)>c(H+)>c(OH-)或c(Cl-)>c(H+)>c(NH4+)>c(OH-).
(1)氮气的电子式为:
 ,在加热、催化剂条件下,氨气和氧气发生氧化还原反应生成水和一氧化氮,反应方程式为:4NH3+5O2
,在加热、催化剂条件下,氨气和氧气发生氧化还原反应生成水和一氧化氮,反应方程式为:4NH3+5O2
| ||
| △ |
故答案为:
 ;4NH3+5O2
;4NH3+5O2
| ||
| △ |
(2)比较两种元素的非金属性强弱,可根据单质之间的置换反应、与氢气反应的难易程度、氢化物的稳定性以及最高正价氧化物对应水化物酸性强弱,注意氧元素自身不能形成氧化物,
①不能根据两种气态氢化物的沸点确定非金属性强弱,故错误;
②比较两种气态氢化物的稳定性能确定非金属性强弱,故正确;
③氧元素自身不能形成氧化物,故错误;
④氧元素自身不能形成氧化物,故错误;
故选①③④;
(3)1mol气体二氧化氮发生反应③放出46kJ热量,则3mol二氧化氮和水反应放出138kJ热量,所以二氧化氮与水反应的热化学反应方程式为3NO2(g)+H2O(l)=2HNO3(aq)+NO(g);△H=-138kJ/mol,
故答案为:3NO2(g)+H2O(l)=2HNO3(aq)+NO(g);△H=-138kJ/mol;
(4)在常温下,向V1L pH=a的氨水溶液中c(OH-)=10 a-14 mol/L,
V2L pH=b的盐酸溶液中c(H+)=10-b mol/L,且a+b=14,所以c(OH-)=c(H+)=10-b mol/L=10 a-14 mol/L<c(NH3.H2O),
若反应后溶液的pH<7,则盐酸应过量,所以v1和v2的关系为V1<V2,
溶液呈酸性,则c(OH-)<c(H+),如果溶液中的溶质氯化铵多,则离子大小顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-),如果溶液中的溶质盐酸多,则离子浓度大小顺序是c(Cl-)>c(H+)>c(NH4+)>c(OH-),故答案为:c(Cl-)>c(NH4+)>c(H+)>c(OH-)或c(Cl-)>c(H+)>c(NH4+)>c(OH-).
点评:本题考查无机推断,涉及知识点较多,能正确推断物质是解本题关键,难点是判断离子浓度大小顺序,根据溶液中的溶质来分析解答,难度较大.

练习册系列答案
相关题目
 (2013?红桥区二模)如图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器.当其他条件相同时,在Ⅰ、Ⅱ中分别加入2mol X和2mol Y,开始时容器的体积均为VL,发生反应2X(?)+Y(?)?aZ(g)并达到平衡状态此时Ⅰ中X、Y、Z的物质的量之比为1:3:2.下列判断正确的是( )
(2013?红桥区二模)如图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器.当其他条件相同时,在Ⅰ、Ⅱ中分别加入2mol X和2mol Y,开始时容器的体积均为VL,发生反应2X(?)+Y(?)?aZ(g)并达到平衡状态此时Ⅰ中X、Y、Z的物质的量之比为1:3:2.下列判断正确的是( ) (2013?红桥区二模)为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究.
(2013?红桥区二模)为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究.