题目内容
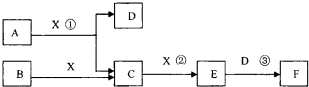
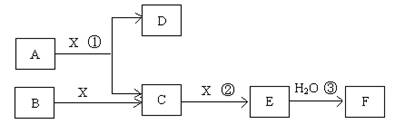
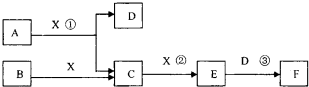
已知由短周期常见元素形成的纯净物A、B、C、D、E转化关系如图1所示,物质A与物质B之间的反应不在溶液中进行(E可能与A、B两种物质中的某种相同).

请回答下列问题:
(1)若A为金属单质,C是淡黄色固体,D是一元强碱.
①写出A的离子结构示意图
 ;
;
②C的电子式为
 ;
;
③D与等物质的量醋酸反应所得溶液的pH
(2)若A为非金属单质,C是有色气体,D是一元强酸.
①写出A与B反应的化学方程式:
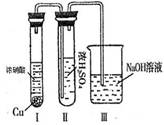
②有人认为“浓H2SO4可以干燥气体C”.某同学为了验证该观点是否正确,用如图2装置进行实验.实验过程中,浓H2SO4中未发现有气体逸出,且浓H2SO4由无色变为红棕色,由此你得出的结论是:
③已知常温下1mol气体C与H2O反应生成D溶液和E气体放出46kJ热量,写出气体C与H2O反应生成D溶液和E气体的热化学方程式:

请回答下列问题:
(1)若A为金属单质,C是淡黄色固体,D是一元强碱.
①写出A的离子结构示意图


②C的电子式为


③D与等物质的量醋酸反应所得溶液的pH
>
>
7(填>,<,=);若在常温下,向pH=a的醋酸溶液中加入等体积pH=b的D溶液,且a+b=14,则充分反应后,所得溶液中各种离子的浓度由大到小的顺序是:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
.(2)若A为非金属单质,C是有色气体,D是一元强酸.
①写出A与B反应的化学方程式:
2NO+O2=2NO2
2NO+O2=2NO2
.②有人认为“浓H2SO4可以干燥气体C”.某同学为了验证该观点是否正确,用如图2装置进行实验.实验过程中,浓H2SO4中未发现有气体逸出,且浓H2SO4由无色变为红棕色,由此你得出的结论是:
NO2能溶于浓硫酸中,浓硫酸不能干燥NO2
NO2能溶于浓硫酸中,浓硫酸不能干燥NO2
.③已知常温下1mol气体C与H2O反应生成D溶液和E气体放出46kJ热量,写出气体C与H2O反应生成D溶液和E气体的热化学方程式:
3NO2(g)+H2O(l)=2HNO3(aq)+NO(g);△H=-138kJ/mol
3NO2(g)+H2O(l)=2HNO3(aq)+NO(g);△H=-138kJ/mol
.分析:(1)若A为金属单质,C是淡黄色固体,应为Na2O2,则A为Na,D是一元强碱,应为NaOH;
(2)C是有色气体,应为NO2,A为非金属单质,应为O2,则B为NO,D为HNO3,结合物质的性质解答该题.
(2)C是有色气体,应为NO2,A为非金属单质,应为O2,则B为NO,D为HNO3,结合物质的性质解答该题.
解答:解:(1)若A为金属单质,C是淡黄色固体,应为Na2O2,则A为Na,D是一元强碱,应为NaOH,则
①A为Na,离子核电荷数为11,原子核外由2个电子,最外层电子数为10,结构示意图为 ,
,
故答案为: ;
;
②C为Na2O2,为离子化合物为,电子式为 ,故答案为:
,故答案为: ;
;
③D为NaOH,与等物质的量醋酸反应生成CH3COONa,为强碱弱酸盐,溶液呈碱性,pH>7,
若在常温下,向pH=a的醋酸溶液中加入等体积pH=b的NaOH溶液,且a+b=14,则有
,
解之得:c(H+)=c(OH-),而醋酸为弱酸,则醋酸过量,反应后溶液呈酸性,
则有c(CH3COO-)>c(Na+),c(H+)>c(OH-)且c(Na+)>c(H+),
所以c(CH3COO-)>c(Na+)>c(H+)>c(OH-),
故答案为:>;c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
(2)C是有色气体,应为NO2,A为非金属单质,应为O2,则B为NO,D为HNO3,则
①NO和O2反应生成NO2,反应的化学方程式为2NO+O2=2NO2,故答案为:2NO+O2=2NO2;
②由现象实验过程中,浓H2SO4中未发现有气体逸出,且浓H2SO4由无色变为红棕色,可以得出NO2能溶于浓硫酸中,
故答案为:NO2能溶于浓硫酸中,浓硫酸不能干燥NO2;
③已知:3NO2+H2O=2HNO3+NO,1molNO2与水反应放出46kJ热量,则3molNO2与水反应放出46kJ×3=138 kJ热量,
所以反应的热化学方程式为3NO2(g)+H2O(l)=2HNO3(aq)+NO(g);△H=-138 kJ/mol,
故答案为:3NO2(g)+H2O(l)=2HNO3(aq)+NO(g);△H=-138 kJ/mol.
①A为Na,离子核电荷数为11,原子核外由2个电子,最外层电子数为10,结构示意图为
 ,
,故答案为:
 ;
;②C为Na2O2,为离子化合物为,电子式为
 ,故答案为:
,故答案为: ;
;③D为NaOH,与等物质的量醋酸反应生成CH3COONa,为强碱弱酸盐,溶液呈碱性,pH>7,
若在常温下,向pH=a的醋酸溶液中加入等体积pH=b的NaOH溶液,且a+b=14,则有
|
解之得:c(H+)=c(OH-),而醋酸为弱酸,则醋酸过量,反应后溶液呈酸性,
则有c(CH3COO-)>c(Na+),c(H+)>c(OH-)且c(Na+)>c(H+),
所以c(CH3COO-)>c(Na+)>c(H+)>c(OH-),
故答案为:>;c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
(2)C是有色气体,应为NO2,A为非金属单质,应为O2,则B为NO,D为HNO3,则
①NO和O2反应生成NO2,反应的化学方程式为2NO+O2=2NO2,故答案为:2NO+O2=2NO2;
②由现象实验过程中,浓H2SO4中未发现有气体逸出,且浓H2SO4由无色变为红棕色,可以得出NO2能溶于浓硫酸中,
故答案为:NO2能溶于浓硫酸中,浓硫酸不能干燥NO2;
③已知:3NO2+H2O=2HNO3+NO,1molNO2与水反应放出46kJ热量,则3molNO2与水反应放出46kJ×3=138 kJ热量,
所以反应的热化学方程式为3NO2(g)+H2O(l)=2HNO3(aq)+NO(g);△H=-138 kJ/mol,
故答案为:3NO2(g)+H2O(l)=2HNO3(aq)+NO(g);△H=-138 kJ/mol.
点评:本题考查较为综合,题目难度较大,易错点为(1),注意溶液中离子浓度大小比较的方法.

练习册系列答案
相关题目