题目内容
在某温度下,将H2和I2各0.10mol 的气态混合物充入10L的密闭容器中,充分反应,达到平衡后,测得 c(H2)= 0.0080mol/L
(1)求该反应的平衡常数。
(2)在上述温度下,该容器中若通入H2和I2各0.20mol 的气态混合物,试求达到化学平衡状态时各物质的物质的量浓度。
(1)求该反应的平衡常数。
(2)在上述温度下,该容器中若通入H2和I2各0.20mol 的气态混合物,试求达到化学平衡状态时各物质的物质的量浓度。
(14分) (1)K = 0.25(5分)
(2)(各3分)平衡时[H2] =" 0.016mol/L" [I2] = 0.016mol/L [HI] = 0.0080mol/L
(2)(各3分)平衡时[H2] =" 0.016mol/L" [I2] = 0.016mol/L [HI] = 0.0080mol/L
试题分析: H2 + I2
 2HI
2HI起始浓度(mol/L) 0.01 0.01 0
转化浓度(mol/L) 0.002 0.002 0.004
平衡浓度(mol/L) 0.008 0.008 0.004
所以该反应的平衡常数K=
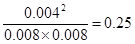
H2 + I2
 2HI
2HI起始浓度(mol/L) 0.02 0.02 0
转化浓度(mol/L) x x x
平衡浓度(mol/L) 0.02-x 0.02-x 2x
所以根据反应的平衡常数K可知
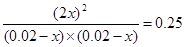
解得x=0.004mol/L
则平衡时c(H2)=0.016mol/L
c(I2)=0.016mol/L
c(HI)=0.0080mol/L
点评:在进行可逆反应的有关计算时,一般采用“三段式”进行,即分别列出起始量、转化量和平衡量或某深刻的量,然后依据已知条件列式计算即可。有利于培养学生的逻辑推理能力和规范答题能力。

练习册系列答案
相关题目
 2C(g),在2min后反应达到平衡时,测得混合气体共3.4moL,生成0.4moLC, 则下列计算结果不正确的是( )
2C(g),在2min后反应达到平衡时,测得混合气体共3.4moL,生成0.4moLC, 则下列计算结果不正确的是( ) C (g) + D(g),能说明该反应达到化学平衡状态的是
C (g) + D(g),能说明该反应达到化学平衡状态的是 3M + N ;△H<0,其中A.B.M.N均为气态, 在一定条件下达到平衡后, A 在反应混合物中的百分含量为 a% , 若要通过改变条件使 a% 改变为 2a%, 那么下列各项可以改变的条件中应选择的是:
3M + N ;△H<0,其中A.B.M.N均为气态, 在一定条件下达到平衡后, A 在反应混合物中的百分含量为 a% , 若要通过改变条件使 a% 改变为 2a%, 那么下列各项可以改变的条件中应选择的是: 
 zC(g),达到平衡后测得A的浓度为0.20mol/L。在恒温下增大压强使容器容积缩小为原来的一半,再次达到平衡时,测得A的浓度为0.35mol/L。下列说法不正确的是( )
zC(g),达到平衡后测得A的浓度为0.20mol/L。在恒温下增大压强使容器容积缩小为原来的一半,再次达到平衡时,测得A的浓度为0.35mol/L。下列说法不正确的是( ) 2NO2(g);△H=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示。下列说法正确的是( )
2NO2(g);△H=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示。下列说法正确的是( )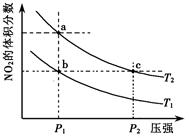
 HBr+ HBrO 加入 AgNO3溶液后,溶液颜色变浅
HBr+ HBrO 加入 AgNO3溶液后,溶液颜色变浅