题目内容
在10L密闭容器中,1moLA和3moLB在一定条件下反应:
A(g)+xB(g) 2C(g),在2min后反应达到平衡时,测得混合气体共3.4moL,生成0.4moLC, 则下列计算结果不正确的是( )
2C(g),在2min后反应达到平衡时,测得混合气体共3.4moL,生成0.4moLC, 则下列计算结果不正确的是( )
A(g)+xB(g)
 2C(g),在2min后反应达到平衡时,测得混合气体共3.4moL,生成0.4moLC, 则下列计算结果不正确的是( )
2C(g),在2min后反应达到平衡时,测得混合气体共3.4moL,生成0.4moLC, 则下列计算结果不正确的是( )| A.平衡时,物质的量之比A︰B︰C=2︰11︰4 |
| B.x值等于4 |
| C.A的转化率为20% |
| D.平衡时B的平均反应速率为0.04moL/(L·min) |
A
试题分析:反应达到平衡时,混合气体为3.4moL,生成0.4moLC, 所以消耗的A为0.2mol,消耗的B为3-[3.4-(1-0.2+0.4)]=0.8,根据=,所以x为4故B正确;A的转化率=0.2/1×100%=20%,故C正确;平衡时B的平均反应速率=0.8/10/2=0.04moL/(L·min),故D正确;平衡时,A的物质的量为0.8mol,B的物质的量为3.4-(1-0.2+0.4)=2.2mol,所以平衡时物质的量之比A︰B︰C=0.8:2.2:0.4=4:11:2,故A不正确,为本题的答案。
点评:本题考查了化学平衡的知识点,该考点是高考考查的重点,本题涉及了化学平衡的计算,难度适中。

练习册系列答案
相关题目
 N2O4,测得NO2转化率为a%。在温度、体积不变时,再通入1molNO2,待新平衡建立时,测得NO2的转化率为b%, a与b比较
N2O4,测得NO2转化率为a%。在温度、体积不变时,再通入1molNO2,待新平衡建立时,测得NO2的转化率为b%, a与b比较  CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换) 密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO 和2 mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是( )
CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换) 密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO 和2 mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是( )
 CH3OH(g)
CH3OH(g)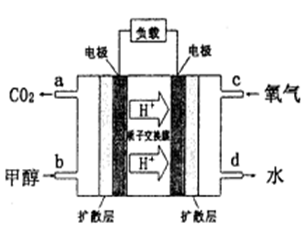
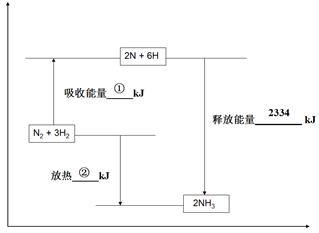
 2NH3(g) ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示。反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为
2NH3(g) ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示。反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为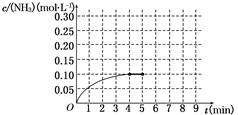
 2HI(g) 达到平衡状态时的标志是
2HI(g) 达到平衡状态时的标志是