题目内容
12.在注射器内充入NO2,平衡后在恒温下进行压缩,当体积减小$\frac{1}{4}$时,则( )| A. | 体系颜色比原来深 | B. | 体系颜色比原来浅 | ||
| C. | 体系颜色不变 | D. | 注射器内压强不变 |
分析 减小体积,二氧化氮的浓度增大,则气体颜色加深,同时增大气体压强,根据勒夏特列原理分析平衡向气体体积减小的方向移动,但只能减弱这种改变,不能消除.
解答 解:减小体积,二氧化氮的浓度增大,则气体颜色加深,同时增大气体压强,根据勒夏特列原理分析平衡向气体体积减小的方向移动,但只能减弱这种改变,不能消除,
A、减小体积,二氧化氮的浓度增大,则气体颜色加深,故A正确;B、C错误;
D、体系压强增大,故D错误;
故选A.
点评 本题考查了化学平衡的移动,利用勒夏特列原理分析时注意平衡移动的结果只能减弱改变,但不能消除,题目难度不大.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案
相关题目
2.下列各组物质间反应可能包括多步反应,其总的离子方程式正确的是( )
| A. | 在硫酸工艺流程中,对尾气中的SO2用过量的氨水吸收的反应2NH3•H2O+SO2=2NH4++SO32-+H2O | |
| B. | FeCl2在空气中被氧化 4Fe2++O2+2H2O=4Fe3++4OH- | |
| C. | AlCl3溶液中通入过量的NH3:Al3++4NH3•H2O=AlO2-+4NH4+ | |
| D. | FeBr2 (aq) 中通入少量Cl2 2Fe2++4Br-+3Cl2=2Fe3++2 Br2+6Cl- |
3.下列说法正确的是( )
| A. | 稀释浓硫酸时,将水沿器壁缓缓注入浓硫酸中 | |
| B. | 化学上分离出的杂质不是有害的就是没价值的 | |
| C. | 实验室取用液体药品时,如没有特殊说明用量,一般取1-2ml | |
| D. | 进行萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
20.下列各组物质间的反应与反应类型不相符的是( )
| A. | 乙烯与溴水(加成反应) | |
| B. | 甲苯与浓硝酸(硝化反应) | |
| C. | 氯乙烷与氢氧化钠醇溶液 (取代反应) | |
| D. | 乙烯与高锰酸钾(氧化反应) |
7.下面有关电化学的图示,完全正确的是( )
| A. | 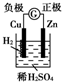 Cu-Zn原电池 | B. | 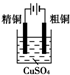 粗铜的精炼 | ||
| C. | 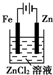 铁片镀锌 | D. | 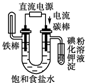 验证NnCl溶液(含酚酞) |
4.下列混合溶液中,各离子浓度的大小顺序正确的是( )
| A. | 10mL0.1mol/L氨水与10mL0.1mol/L盐酸混合,c(Cl-)>c(NH${\;}_{4}^{+}$)>c(OH-)>c(H+) | |
| B. | 10mL0.1mol/L NH4Cl溶液与5mL0.2mol/LNaOH溶液混合,c(Na+)=c(Cl-)>c(OH-)>c(H+) | |
| C. | 10mL0.1mol/LCH3COOH溶液与5mL0.2mol/LNaOH溶液混合,c(Na+)=c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 10mL0.5mol/LCH3COONa溶液与6mL 1mol/L盐酸混合,c(Na+)=c(Cl-)>c(H+)>c(OH-) |
1.分类法在化学学科的发展中起到了非常重要的作用,下列分类标准不合理的是( )
| A. | 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 | |
| B. | 根据反应中是否有电子转移,将化学反应分为氧化还原反应和非氧化还原反应 | |
| C. | 根据是否含氧元素,将物质分为氧化剂和还原剂 | |
| D. | 根据水溶液或熔融状态是否能够导电,将化合物分为电解质和非电解质 |
2.某课外兴趣小组对H2O2的分解速率做了如下实验探究:
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:用l0mL H2O2制取150mL O2所需的时问(s)
①验证影响反应速率的因素时要考试控制变量.取相同浓度的H2O2进行实验,上表反应条件中考虑控制单因子变量的是温度、浓度、催化剂.
②对照反应条件a和b,可以说明催化剂 因素对过氧化氢分解的速率有影响,该影响可具体表述为催化剂加快分解速率.
(2)将质量相同但聚集状态不同的MnO2分别加入到5mL 5%的双氧水中,并用带火星的木条测试.测试结果加下.
①写出加入MnO2后H2O2发生反应的化学方程式2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
②上述实验中,使用粉末状催化剂和块状催化剂所得过氧化氢分解反应的反应速率之比为10:1.
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:用l0mL H2O2制取150mL O2所需的时问(s)
| 浓度 时间(s) 反应条件 | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| 无催化剂、不加热(t1℃) | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热(t2℃) | 360(a) | 480 | 540 | 720 |
| MnO2催化剂、加热(t2℃) | 10(b) | 25 | 60 | 120 |
②对照反应条件a和b,可以说明催化剂 因素对过氧化氢分解的速率有影响,该影响可具体表述为催化剂加快分解速率.
(2)将质量相同但聚集状态不同的MnO2分别加入到5mL 5%的双氧水中,并用带火星的木条测试.测试结果加下.
| 催化剂(MnO2) | 操作情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3min |
| 块状 | 反应较慢,火星红亮但木条未复燃 | 30min |
②上述实验中,使用粉末状催化剂和块状催化剂所得过氧化氢分解反应的反应速率之比为10:1.