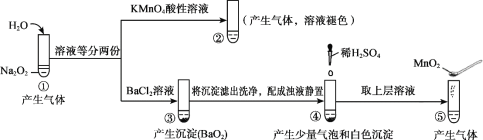
题目内容
【题目】用下列装置进行相应实验,能达到实验目的的是( )

A.用图1装置可证明非金属性强弱:Cl>C>Si
B.用图2装置可制备少量O2,其优点是能随时控制反应的发生和停止
C.用图3装置可配制100mL一定物质的量浓度的硫酸溶液
D.用图4装置可蒸发NaCl溶液得到氯化钠晶体
【答案】D
【解析】
A.元素的非金属性越强,其最高价氧化物的水化物酸性越强,HCl不是Cl元素的最高价氧化物的水化物,而且盐酸易挥发导致生成的二氧化碳中含有HCl,HCl和硅酸钠反应影响二氧化碳的反应,所以不能据此判断非金属性强弱,故A错误;
B.过氧化钠是粉末状固体,所以不能用简易启普发生器、过氧化钠和水制取氧气,故B错误;
C.容量瓶不能稀释或溶解药品,应该将浓硫酸在烧杯中稀释,冷却至室温后再转移到容量瓶中,故C错误;
D.用图4装置可蒸发NaCl溶液得到氯化钠晶体,故D正确;
故答案为D。

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
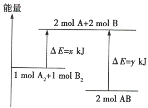
【题目】通常人们把拆开1mol某化学键所吸收的能量或形成1mol某化学键所释放的能量看作该化学键的键能,键能的大小可用于估算化学反应的反应热(△H),已知:
化学键 | H-H | Cl-Cl | H-Cl |
键能 | 436kJ/mol | 243kJ/mol | 431kJ/mol |
则下列热化学方程式不正确的是___(把正确的一个选项填在横线上)
a.![]() H2(g)+
H2(g)+![]() Cl2(g)═HCl(g) △H=﹣91.5kJmol﹣1
Cl2(g)═HCl(g) △H=﹣91.5kJmol﹣1
b.H2(g)+Cl2(g)═2HCl(g) △H=﹣183kJmol﹣1
c.2HCl(g)═H2(g)+Cl2(g) △H=+183kJmol﹣1
d.![]() H2(g)+
H2(g)+![]() Cl2(g)═HCl(g) △H=+91.5kJmol﹣1
Cl2(g)═HCl(g) △H=+91.5kJmol﹣1