题目内容
【题目】为证明铜丝与稀硝酸反应生成的确实是NO,某同学设计了一套装置(如图甲所示),有关该实验叙述不正确的是( )
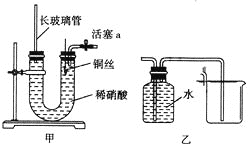
A.为保证实验效果,反应开始前,稀硝酸可加到与两侧胶塞相平的位置
B.利用该装置可控制反应随时停止或继续反应
C.生成的气体可利用图乙来收集
D.长玻璃管的作用可防止稀硝酸溢出
【答案】C
【解析】
A.反应开始前,稀硝酸加到与两侧胶塞相平的位置,目的是排出U形管中的空气,防止![]() 干扰实验,故A正确;
干扰实验,故A正确;
B.关闭活塞a,反应产生的气体可使铜丝与稀硝酸不接触,反应停止,打开活塞a,稀硝酸与铜丝接触又发生反应,故B正确;
C.若用图乙收集NO,应将广口瓶中长导管换成短导管、短导管换成长导管,故C错误;
D.关闭活塞a,U形管内压强增大,稀硝酸被压入玻璃管,可防止稀硝酸溢出,故D正确;
故答案为C。

 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案【题目】氮及其化合物在工农业生产、生活中有着重要作用。完成下列填空:
合成氨工业中:N2(g)+3H2(g)![]() 2NH3(g)△H<0,其化学平衡常数K与温度t的关系如表:
2NH3(g)△H<0,其化学平衡常数K与温度t的关系如表:
t/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
(1)试比较K1、K2的大小,K1________ K2(填写“>”、“=”或“<”)
(2)400℃时,反应2NH3(g)![]() N2(g)+3H2(g)的化学平衡常数的值为_____________。当测得NH3和N2、H2的物质的量浓度分别为3mol/L和2mol/L、1mol/L时,则该反应υ(N2)(正)___________υ(N2)(逆)(填写“>”、“=”或“<”)
N2(g)+3H2(g)的化学平衡常数的值为_____________。当测得NH3和N2、H2的物质的量浓度分别为3mol/L和2mol/L、1mol/L时,则该反应υ(N2)(正)___________υ(N2)(逆)(填写“>”、“=”或“<”)
(3)在密闭恒容的容器中,下列能作为合成氨反应达到平衡的依据的是____________。
a.υ(N2)(正)=3υ(H2)(逆)b.混合气体的密度保持不变
c.容器内压强保持不变d.N2、H2、NH3的浓度之比为1∶3∶2
(4)化工生产为做到又“快”又“多”采用多种方法,试写出两项合成氨工业中为实现“多”所采取的措施:__________________________,__________________________。
(5)0.1mol/L的(NH4)2SO4水溶液中各离子浓度由大到小的顺序是_____________________,在该溶液中加入少量明矾固体,溶液中![]() 的浓度_______(填“增大”、“减小”或“不变”),其原因是___________________。
的浓度_______(填“增大”、“减小”或“不变”),其原因是___________________。
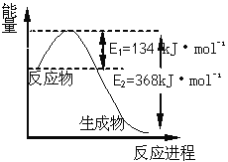
(6)如图是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式_____________________________________________。