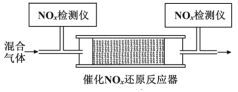
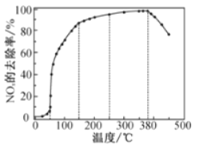
题目内容
【题目】通常人们把拆开1mol某化学键所吸收的能量或形成1mol某化学键所释放的能量看作该化学键的键能,键能的大小可用于估算化学反应的反应热(△H),已知:
化学键 | H-H | Cl-Cl | H-Cl |
键能 | 436kJ/mol | 243kJ/mol | 431kJ/mol |
则下列热化学方程式不正确的是___(把正确的一个选项填在横线上)
a.![]() H2(g)+
H2(g)+![]() Cl2(g)═HCl(g) △H=﹣91.5kJmol﹣1
Cl2(g)═HCl(g) △H=﹣91.5kJmol﹣1
b.H2(g)+Cl2(g)═2HCl(g) △H=﹣183kJmol﹣1
c.2HCl(g)═H2(g)+Cl2(g) △H=+183kJmol﹣1
d.![]() H2(g)+
H2(g)+![]() Cl2(g)═HCl(g) △H=+91.5kJmol﹣1
Cl2(g)═HCl(g) △H=+91.5kJmol﹣1
【答案】d
【解析】
根据所给的反应和表格中的键能,先判断出断键吸收的热量和成键放出的热量,然后用断键吸收的热量减去成键放出的热量既得反应热,据此计算。
a.![]() H2(g)+
H2(g)+![]() Cl2(g)=HCl(g)△H=
Cl2(g)=HCl(g)△H=![]() ×436kJmol-1+
×436kJmol-1+![]() ×243 kJmol-1-431kJmol-1=-91.5kJmol-1,故a正确;
×243 kJmol-1-431kJmol-1=-91.5kJmol-1,故a正确;
b.H2(g)+Cl2(g)=2HCl(g) △H=436kJmol-1+243 kJmol-1-(2×431)kJmol-1=-183 kJmol-1,故b正确;
c.2HCl(g)=H2(g)+Cl2(g) △H=(2×431)kJmol-1-(436kJmol-1+243 kJmol-1)△H=+183 kJ/mol,故c正确;
d.![]() H2(g)+
H2(g)+![]() Cl2(g)=HCl(g)△H=
Cl2(g)=HCl(g)△H=![]() ×436kJmol-1+
×436kJmol-1+![]() ×243 kJmol-1-431kJmol-1=-91.5kJmol-1,故d错误;
×243 kJmol-1-431kJmol-1=-91.5kJmol-1,故d错误;
故答案为d。

【题目】下列各组物质能满足如图所示转化关系的是(图中箭头表示一步转化)
a | b | c | d |
| |
① | S | SO2 | H2SO3 | H2SO4 | |
② | Si | SiO2 | H2SiO3 | Na2SiO3 | |
③ | Cu | CuO | CuSO4 | Cu(OH)2 | |
④ | N2 | NO | NO2 | HNO3 |
A. ②③ B. ①④ C. ①② D. ③④
【题目】化学理论较为枯燥,若用化学实验来阐释理论,则会使理论具有趣味性,某班级化学学习小组通过实验室制备CO2的反应探究某些化学理论。下表是实验过程中的数据及相关信息:
序号 | 反应 温度/℃ | c(HCl)/(mol·L-1) | V(HCl)/mL | 10g CaCO3 的形状 | t/min |
① | 20 | 2 | 10 | 块状 | t1 |
② | 20 | 4 | 10 | 块状 | t2 |
③ | 20 | 2 | 10 | 粉状 | t3 |
④ | 40 | 2 | 10 | 粉状 | t4 |
⑤ | 40 | 4 | 10 | 粉状 | t5 |
![]() 表示收集/span>CO2体积为a mL所需的时间。注:气体体积均在相同条件下测得。
表示收集/span>CO2体积为a mL所需的时间。注:气体体积均在相同条件下测得。
(1)由表中的信息可知,实验的目的是探究__________。
(2)表格中的实验①和实验②是探究_____对化学反应速率的影响。分析表格中的信息可知,影响该化学反应速率的因素还有______________________________。
(3)收集a mLCO2所需的时间最少的是实验______________________________。