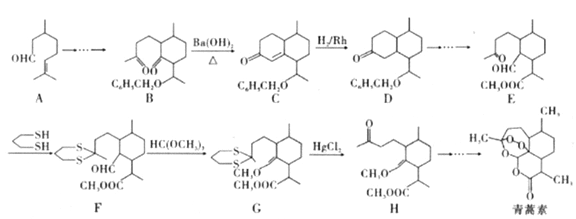
题目内容
【题目】已知下列反应的反应热为:
(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1 = -870.3KJ/mol
(2)C(s)+O2(g)=CO2(g) △H2 = -393.5KJ/mol
(3)H2(g)+![]() O2(g)=H2O(l) △H3 = -285.8KJ/mol
O2(g)=H2O(l) △H3 = -285.8KJ/mol
试计算下列反应的反应热:
2C(s)+2H2(g)+O2(g)=CH3COOH(l) H =
【答案】-488.3kJ/mol
【解析】
试题分析:已知(1)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJmol-1
(2)C(s)+O2(g)═CO2(g)△H=-393.5kJmol-1
(3)H2(g)+1/2O2(g)═H2O(l)△H=-285.8kJmol-1
据盖斯定律,(2)×2+(3)×2-(1)得:
2C(s)+2H2(g)+O2(g)═CH3COOH(l)△H=-488KJ/mol。

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目