题目内容
在Cu2S+2Cu2O 6Cu+SO2↑反应中,下列说法中正确的是( )
6Cu+SO2↑反应中,下列说法中正确的是( )
| A.Cu2O在反应中被氧化 |
| B.Cu2S在反应中既是氧化剂又是还原剂 |
| C.Cu既是氧化产物又是还原产物 |
| D.若反应中转移12 mol电子,则生成6 mol Cu |
B
解析

某含铬Cr2O72-废水用硫酸亚铁铵[FeSO4·(NH4)2 SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀干燥后得到n molFeO·FeyCrxO3,其中Cr的化合价为+3价。不考虑处理过程中的实际损耗,下列叙述错误的是
| A.消耗硫酸亚铁铵的物质的量为n(2-x)mol |
B.处理废水中Cr2O72- 的物质的量为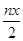 mol mol |
| C.反应中转移的电子为3nx mol |
| D.在FeO·FeyCrxO3中3x=y |
标准状况下,将a L SO2和Cl2组成的混合气体通入100 mL 0.2 mol·L-1Fe2(SO4)3溶液中,充分反应后,溶液的棕黄色变浅。向反应后的溶液中加入足量的BaCl2溶液,将所得沉淀过滤、洗涤、干燥后称重,其质量为23.3 g。则下列关于该过程的推断不正确的是
| A.混合气体中氯气物质的量为0.04 mol |
| B.混合气体中SO2物质的量为0.04 mol |
| C.所得的沉淀为0.1 mol BaSO4 |
| D.a的取值范围为1.344< a <1.792 |
已知反应:O3 + 2I- + H2O = O2 + I2 + 2OH-,下列说法不正确的是
| A.O3和O2是同素异形体 | B.H2O既不是氧化剂也不是还原剂 |
| C.氧化性:I2>O2 | D.反应生成1mol I2时转移2 mol电子 |
LiAlH4是重要的储氢材料,其组成类似于Na3AlF6。常见的供氢原理如下面两个方程式所示:
①2LiAlH4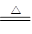 2LiH+2Al+3H2↑
2LiH+2Al+3H2↑
②LiAlH4+2H2O=LiAlO2+4H2↑
下列说法正确的是( )
| A.LiAlH4是共价化合物,LiH是离子化合物 |
| B.生成等质量的氢气,反应①、②转移电子数之比为4?3 |
| C.氢化锂也是一种储氢材料,供氢原理为LiH+H2O=LiOH+H2↑ |
| D.若反应①中生成3.36 L氢气,则一定有2.7 g铝生成 |
向100 mL 18 mol/L的硫酸中加入足量铜片,加热并充分反应。下列有关说法正确的是( )
| A.充分反应后转移1.8 mol电子 |
| B.H2SO4只作氧化剂 |
| C.若不加热应生成H2 |
| D.消耗的铜的质量一定少于57.6 g |
工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对生态系统造成很大的损害,其中还原沉淀法是常用的一种处理方法。流程如下:
\其中第①步中存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O。下列有关说法正确的是( )
Cr2O72—(橙色)+H2O。下列有关说法正确的是( )
| A.第①步当2v(Cr2O72—)=v(CrO42—)时,达到了平衡状态 |
| B.对于上述平衡,加入适量稀硫酸后,溶液颜色变黄色,则有利于CrO42—的生成 |
| C.第②步中,还原0.1 mol Cr2O72—需要45.6 g FeSO4 |
| D.第③步沉淀剂a可以使用NaOH等碱性物质 |
在熔融KOH中,大气中的氧可将铬铁矿(FeCr2O4)中Fe和Cr的化合价都转化为+6价,氧化1 mol FeCr2O4在理论上需要氧气( )
| A.2 mol | B.2.5 mol | C.3 mol | D.4 mol |
某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3—、N2、Cl-六种物质。在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是( )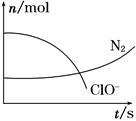
| A.还原剂是含CN-的物质,氧化产物只有N2 |
| B.氧化剂是ClO- , 还原产物是HCO3— |
| C.配平后氧化剂与还原剂的化学计量数之比为5∶2 |
| D.若生成2.24 L N2(标准状况),则转移电子0.5 mol |