题目内容
14.对于H3O+的下列说法中正确的是( )| A. | O原子采用SP2杂化 | B. | O原子采用SP3杂化 | ||
| C. | 离子中不存在配位键 | D. | 离子中存在非极性键 |
分析 根据价层电子对互斥理论确定其空间构型,价层电子对数=σ 键个数+$\frac{1}{2}$(a-xb);H3O+是H+与H2O通过配位键形成;H3O+离子中不存在非极性键,存在的都是H-O极性共价键.
解答 解:A.H3O+中,价层电子对数=3+$\frac{1}{2}$(6-1-3×1)=4,在H3O+中O原子成3个σ键,其中含有1个配位键,有一对未成键的孤对电子,杂化轨道数为4,采取sp3型杂化杂化,
故A错误;
B.由A项分析可知O原子采用SP3杂化,故B错误;
C.H3O+是H+与H2O通过配位键形成的,则离子中存在配位键,故C错误;
D.H3O+离子中不存在非极性键,存在的都是H-O极性共价键,故D错误.
故选:B.
点评 本题考查了杂化理论的应用、配位键、共价键的极性,题目难度中等,注意理解价层电子对互斥理论与杂化轨道理论.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
4.五种如表所示的短周期主族元素,下列说法不正确的是( )
| X | L | Z |
| Y | W |
| A. | Y的原子半径一定比L的大 | |
| B. | 若 X、Y为非金属元素,则X、Y元素形成的单质晶体类型一定相同 | |
| C. | 若X、W能组成XW2型分子,则其空间构型一定为直线型 | |
| D. | 对应简单氢化物的沸点可能是 X>Y、Z>W |
5.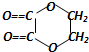 以乙醇为原料,用下述6种类型的反应:①氧化反应;②消去反应;③加成反应;④酯化反应;⑤水解反应;⑥加聚反应,来合成乙二酸乙二酯(结构简式如图所示)的正确顺序是( )
以乙醇为原料,用下述6种类型的反应:①氧化反应;②消去反应;③加成反应;④酯化反应;⑤水解反应;⑥加聚反应,来合成乙二酸乙二酯(结构简式如图所示)的正确顺序是( )
 以乙醇为原料,用下述6种类型的反应:①氧化反应;②消去反应;③加成反应;④酯化反应;⑤水解反应;⑥加聚反应,来合成乙二酸乙二酯(结构简式如图所示)的正确顺序是( )
以乙醇为原料,用下述6种类型的反应:①氧化反应;②消去反应;③加成反应;④酯化反应;⑤水解反应;⑥加聚反应,来合成乙二酸乙二酯(结构简式如图所示)的正确顺序是( )| A. | ①⑤②③④ | B. | ①②③④⑤ | C. | ②③⑤①④ | D. | ②③⑤①⑥ |
2.原子电子层数相同的三种非金属元素A、B、C,已知最高价氧化物对应水化物的酸性HAO4>H2BO4>H3CO4,则下列判断错误的是( )
| A. | 非金属性:A>B>C | B. | 原子序数:A<B<C | ||
| C. | 原子半径:A<B<C | D. | 单质与氢气的化合能力:A>B>C |
9.共价键、离子键和范德华力是构成物质时粒子间的不同作用力,下列物质中,只含有上述一种作用力的是( )
| A. | 干冰 | B. | 氯化钠 | C. | 氢氧化钠 | D. | 碘 |
19.下列叙述正确的是( )
| A. | 在共价化合物中一定存在共价键 | |
| B. | 只存在共价键的物质一定是共价化合物 | |
| C. | 含有共价键的化合物一定是共价化合物 | |
| D. | 离子化合物中只含有离子键 |
3.对于Zn与稀硫酸的反应,下列叙述不正确的是( )


| A. | 反应过程中能量关系可用如图表示: | |
| B. | 若将该反应设计成原电池,锌为负极 | |
| C. | 若将该反应设计成原电池,正极可用石墨 | |
| D. | 若将其设计为原电池,当有32.5 g锌溶解时,正极放出的气体一定为11.2 L |
4.下列四支试管中,双氧水分解的化学反应速率最大的是( )
| 试管 | 温度 | 过氧化氢浓度 | 催化剂 |
| A | 室温(25℃) | 12% | MnO2 |
| B | 室温(25℃) | 4% | 无 |
| C | 水浴加热(50℃) | 12% | 无 |
| D | 水浴加热(50℃) | 12% | MnO2 |
| A. | A | B. | B | C. | C | D. | D |
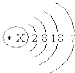 已知溴原子的原子结构示意图如图﹕
已知溴原子的原子结构示意图如图﹕