题目内容
8.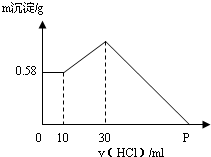 把NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水中后,有0.58g白色沉淀,在所得浊液中逐滴加入0.5mol/L盐酸,加入盐酸体积与生成沉淀的质量关系如图所示.试求:
把NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水中后,有0.58g白色沉淀,在所得浊液中逐滴加入0.5mol/L盐酸,加入盐酸体积与生成沉淀的质量关系如图所示.试求:①混合物中NaOH质量;
②混合物中AlCl3质量;
③混合物中MgCl2质量;
④P点所示的盐酸体积.
分析 由生成沉淀的质量关系图可知,滴加的前10mL稀盐酸,没有影响沉淀的量,说明滴加的稀盐酸在与混合物中剩余的氢氧化钠发生反应;继续滴加稀盐酸时,沉淀量增加,此时稀盐酸与NaAlO2发生反应产生Al(OH)3沉淀;此后再滴加的稀盐酸与氢氧化铝和氢氧化镁的沉淀发生反应,直至Mg(OH)2和Al(OH)3沉淀全部溶解;
综合以上分析,混合物中的氢氧化钠溶于水后与氯化镁、氯化铝发生反应后还有剩余,剩余的氢氧化钠与稀盐酸发生反应;固体物中的氯化铝与氢氧化钠反应生成NaAlO2;因此,计算出的质量就可以根据反应的化学方程式计算氯化铝的质量;P点为全部反应完全反应后所消耗稀盐酸的量,需要计算出氢氧化铝、氢氧化镁两种沉淀物完全溶解所消耗稀盐酸的量.
解答 解:从图中可以看出,Mg(OH)2的质量为0.58 g,即0.01 mol,根据反应:MgCl2+2NaOH═2NaCl+Mg(OH)2↓,
m(MgCl2)=0.01 mol×95 g•mol-1=0.95 g,
n1(NaOH)=2n[Mg(OH)2]=0.02 mol.
开始至加入10 mL盐酸,发生反应:NaOH+HCl═NaCl+H2O,
n2(NaOH)=n(HCl)=0.5 mol•L-1×10×10-3L=5×10-3 mol.
盐酸的加入量从10~30 mL 发生反应:NaAlO2+HCl+H2O═Al(OH)3↓+NaCl,
n(NaAlO2)=n(HCl)=0.5 mol•L-1×(30-10)×10-3L=0.01 mol.
根据反应:AlCl3+4NaOH═NaAlO2+3NaCl+2H2O
n3(NaOH)=4n(NaAlO2)=0.04 mol,
m(AlCl3)=0.01 mol×133.5 g•mol-1=1.335 g,
m(NaOH)=(0.02 mol+5×10-3mol+0.04 mol)×40 g•mol-1=2.6 g.
根据反应:Al(OH)3+3HCl═AlCl3+3H2O,
Mg(OH)2+2HCl═MgCl2+2H2O
n(HCl)=0.01 mol×3+0.01 mol×2=0.05 mol
V(HCl)=$\frac{0.05mol}{0.5mol/L}$=0.1L
P点加入盐酸的体积为30mL+100mL=130mL.
答:混合物中NaOH、AlCl3、MgCl2的质量分别是2.6g、1.335g、0.95g;P点所表示的盐酸的体积是130mL.
点评 根据滴加稀盐酸与产生沉淀的关系图,分析各阶段所发生的反应,利用各阶段反应的化学方程式进行相关物质质量的计算;本题所涉及的反应比较复杂,在分析时逐个反应梳理清楚是解决本问题的关键.

| A. | 结晶 | B. | 萃取 | C. | 过滤 | D. | 蒸馏 |
| A. | 44g | B. | 0.335mol | C. | 29.48g | D. | 0.5mol |
| A. | 甲烷和乙烷 | B. | 乙烯和丙烯 | C. | 苯和乙炔 | D. | 乙炔和丙炔 |
| A. | $\frac{b(1-a)}{7}$ | B. | $\frac{1-a}{7}$ | C. | $\frac{a}{8}$ | D. | 无法确定 |
| A. | C(金刚石) | B. | NaCl | C. | C2H6O | D. | CH4 |
| A. | 与12C60的碳原子化学性质不同 | B. | 与14N含的中子数相同 | ||
| C. | 是12C60的同素异形体 | D. | 与12C互为同位素 |
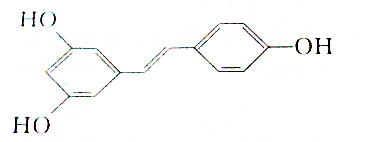 ,则白藜芦醇的分子式为C14H12O3.
,则白藜芦醇的分子式为C14H12O3.